ПОИСК:

4.1.2. Токсины растений
Рассмотрим основные классы токсинов растений и экологическую роль их во взаимоотношениях растений и животных (например, [Harborne, 1982; 1986; Schlee, 1986)].
В самом первом приближении токсины можно разделить на две большие группы: содержащие и не содержащие азот. Ниже освещаются примеры токсинов этих групп, причем иногда для сравнения упоминаются также токсины низших растений. В скобках указано число известных структур обсуждаемого класса токсинов.
Токсины, содержащие азот. Среди этих токсинов различают не менее семи основных групп: небелковые аминокислоты, цианогенные гликозиды, глюкозинолаты, изобутиламиды алифатических кислот, алкалоиды, пептиды, белки.
Небелковые аминокислоты (более 450). Примерами могут быть следующие.
а) 3,4-Диоксифенилалаиин (L-ДОФА). Эта аминокислота токсична для насекомых, значительно менее токсична для млекопитающих. В семенах Mucuna (бобовые) содержание ее достигает 6-9%. Нарушает активность фермента тирозиназы, необходимого для формирования кутикулы насекомых.
б) β-Цианоаланин. Встречается в семенах Vicia (бобовые). Токсичен для млекопитающих: вызывает у крыс конвульсии и смерть при введении в концентрации 200 мг/кг веса тела.
в) Канаванин (например, [Rosenthal, 1986]) встречается в семенах канавалии мечевидной - Canavalia ensiformis (4-6% сырой массы), Dioclea megacarpa (до 7-10% сырой массы). Токсичен для млекопитающих и, вероятно, защищает семена от растительноядных млекопитающих.
г) Азетидин-2-карбоновая кислота из растений семейств бобовых и лилейных, возможно, включается в состав синтезируемых организмом полинептидных цепей и приводит к образованию функционально неактивных белков.
Цианогенные гликозиды (более 60). Сами по себе не токсичны, но энзиматически разрушаются и образуют цианистую кислоту (HCN). Цианид подавляет активность цитохромоксидазы дыхательной цепи митохондрий, что может вызвать кислородное голодание и смерть.
Эти соединения встречаются по меньшей мере у 800 видов из 70-80 семейств. Структура некоторых известных цианогенов показана на рис. 8.
Если заместителями R являются две метальные группы, то этот цианоген называют линамарином. Он встречается у льна Linum и других родов. Если одна из замещающих групп - метил, а другая - этил, то цианоген называют лотаустралином. В семенах горького миндаля содержится амигдалин.
Интересен вопрос о полиморфизме цианогенеза. Образование цианогенных гликозидов (например, линамарина) и фермента, необходимого для его расщепления с образованием HCN, контролируется двумя генами: G и Е. Природные популяции растений распадаются на четыре генотипа: GE, Ge, gE и ge, которые могут выявляться фенотипически подходящим химическим тестом.
Оказалось, что популяции клевера Trifolium repens L. в Англии были преимущественно цианогенными, а в исследованных регионах европейской части России - ацианогенными, Возможное объяснение видят в том, что в изучавшихся районах России после холодной зимы популяции растительноядных моллюсков не успевают быстро вырасти и начальная стадия развития листьев у клевера происходит без угрозы с их стороны. В Англии слизни и Другие моллюски активны круглый год, и для молодых листьев клевера особенно нужна химическая защита. Поэтому цианогенные гено-и фенотипы получают преимущество.
На примере цианогенов интересно рассмотреть биохимическую адаптацию фитофагов к токсинам. У некоторых животных (овец, крупного рогатого скота) детоксикация цианида происходит следующим образом. Его превращает в тиоцианат фермент роданеза:
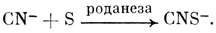
Сера поступает из p-меркаптопирувата (HSCH2CОCО2H), который превращается в пируват.
![Рис. 8. Токсичные и репеллентные для насекомых вещества растений [Jacobson, 1982] 1 - цианогенные гликозиды; 2 - (Е)-5-оцименон (ocimenone); 3 - линалоол (linalool); 4, а, б - пиретрины (pyrethrins); 5 - никотин (nicotine); 6 - анабазин (anabasine); 7- пеллиторин (pellitorine, изобутиламид декановой кислоты); 8 - спилантол (spilanthol) или аффинин (afiinin); 9 - эхинацеин (echinacein) или α-саншоол (sanshool) (неогеркулин, neoherculin); 10 - анациклин (anacycline); 11 - лимонен (Ишопепе); 12 - госсипол (gossypol); 13 - 2-тридеканон *(2-tridecanone); 14 - ротенон (rotenone)](pic/000025.jpg)
Рис. 8. Токсичные и репеллентные для насекомых вещества растений [Jacobson, 1982] 1 - цианогенные гликозиды; 2 - (Е)-5-оцименон (ocimenone); 3 - линалоол (linalool); 4, а, б - пиретрины (pyrethrins); 5 - никотин (nicotine); 6 - анабазин (anabasine); 7- пеллиторин (pellitorine, изобутиламид декановой кислоты); 8 - спилантол (spilanthol) или аффинин (afiinin); 9 - эхинацеин (echinacein) или α-саншоол (sanshool) (неогеркулин, neoherculin); 10 - анациклин (anacycline); 11 - лимонен (Ишопепе); 12 - госсипол (gossypol); 13 - 2-тридеканон *(2-tridecanone); 14 - ротенон (rotenone)
Аналогичным образом при отравлении человека цианидом ему внутривенно вводят тиосульфат.
GN- + Na2S2О3 → CNS- + Na2SО3.
Цианогены имеются у центральноамериканских видов акаций, не образующих мутуализма с муравьями (некоторые другие виды акаций живут под патронажем муравьев, защищающих их от атаки других растительноядных насекомых).
Образование синильной кислоты в качестве защитного средства описано не только у растений, но также и у животных, например у многоножек (защита от нападений муравьев), у некоторых бабочек с предупреждающей окраской.
Глюкози-нолаты (glucosinolates, более 90). Встречаются у растений 10 семейств, в том числе Brassicaceae (синигрин). Токсичность связана с выделением изотиоцианатов (горчичных масел). Кроме того, что изотиоцианаты токсичны, они могут подвергаться дальнейшему превращению с образованием соответствующих тиоцианатов;
R - N = C = S ↔ R - S - C = N,
где R - алкил или бензил.
Последние у млекопитающих вызывают заболевание - гипертироидизм. Глюкозинолаты токсичны и для насекомых, и для крупного рогатого скота.
Изобутиламиды ненасыщенных алифатических кислот. Выделены из растений семейств сложноцветных и рутовых. Примерами являются (см. рис. 8): пеллиторин из корней Anacyclus pyrethrum DC.; спилантол (аффинин) из стебля Spilanthes oleracea Jacq. и из корней Heliopsis longipes (A. Gray) Blake, а также Н. scabra Dunal.; эхинацеин (другие названия - α-саншоол и неохеркулин) из корней Echinacea angustifolia DC., плодов и корней Zanthoxylum piperitum DC. и коры Z. clava-herculis L.; анациклин из корней Anacyclus pyrethrum DC. [Jacobson, 1982].
Алкалоиды (по-видимому, более 7000-8000). Найдены у растений многих семейств. Токсичные свойства растений, содержащих алколоиды, известны очень давно. Весьма гетерогенный класс веществ включает наряду с прочими следующие группы.
1. Производные пиридина и пиперидина. Примеры - н-холиномиметик никотин (из Nicotiana spp.), анабазин (открыт А. П. Ореховым в среднеазиатском растении Anabasis aphylla L.; также содержится в Nicotiana spp.). Оба алкалоида применялись как инсектициды. Еще пример - кониин из болиголова Conium maculatum L. (рис. 9) (считается, что им был отравлен Сократ).
2. Производные пирролидина и тропана. Примеры - стахидрин, гигрин, кокаин, гиосциамин, м-холиноблокатор атропин (из красавки Atropa belladonna L.) .
3. Производные хинолина и изохинолина. Примеры - морфин, кодеин (из опийного мака Papaver somniferum L.), тубокурарин (блокатор н-холинорецепторов скелетных мышц; один из многих алкалоидов некоторых видов яда кураре), пеллотин, норлауданозолин, барберин.
![Рис. 9. Вещества растений, токсичные для фитофагов 1 - кониин (coniine) Conium maculatum L. (Umbelliferae); 2 - атропин (atropine) Atropa belladonna L. (Solanaceae); 3 - соланин (solanine) картофеля Solanum tuberosum L,j 4 - стрихнин (strychnine) Strychnos nuxvomica (Loganiaceae), азотнесодержащие токсичные вещества: 5- энантетоксин (oenanthetoxin) Oenanthe crocata L.; 6 - цикутоксин cicutoxin) (Cicuta virosa L.); 7 - гиперицин (hypericin) Hypericum perforatum L.; 8 - псорален (psoralene) из листьев и стеблей зонтичных [Harborne, 1982]; 9 - фалькариндиол (falcarindiol) моркови -фактор устойчивости растений против нематод и фитоалексин - против грибных паразитов [Stadler, Buser, 1984]; 10 - 6-винил- 7-метокси-2,2- диметилхромен (6-vinyl-7-metoxy-2,2-dimethylchromene) из масла Hemizonia fitchii A. Gray (Asteraceae) [Klocke et al., 1985]](pic/000026.jpg)
Рис. 9. Вещества растений, токсичные для фитофагов 1 - кониин (coniine) Conium maculatum L. (Umbelliferae); 2 - атропин (atropine) Atropa belladonna L. (Solanaceae); 3 - соланин (solanine) картофеля Solanum tuberosum L,j 4 - стрихнин (strychnine) Strychnos nuxvomica (Loganiaceae), азотнесодержащие токсичные вещества: 5- энантетоксин (oenanthetoxin) Oenanthe crocata L.; 6 - цикутоксин cicutoxin) (Cicuta virosa L.); 7 - гиперицин (hypericin) Hypericum perforatum L.; 8 - псорален (psoralene) из листьев и стеблей зонтичных [Harborne, 1982]; 9 - фалькариндиол (falcarindiol) моркови -фактор устойчивости растений против нематод и фитоалексин - против грибных паразитов [Stadler, Buser, 1984]; 10 - 6-винил- 7-метокси-2,2- диметилхромен (6-vinyl-7-metoxy-2,2-dimethylchromene) из масла Hemizonia fitchii A. Gray (Asteraceae) [Klocke et al., 1985]
4. Производные индола. Примеры - стрихнин (из Strychnos mix-vomica), хинамин (из хинного дерева Cinchona spp.), виндолин (из Vinca sp.), серпентин (из Rauwolfia serpentina Benth. et Kurz.), свыше 60 алкалоидов яда кураре.
5. Производные пурина: кофеин, теобромин и др.
6. Стероидные алколоиды. Примеры - соланин (из картофеля Salanum tuberosum L., см. рис. 9), а-томатин (из томата). Есть данные, что соланин может вызывать тератогенез у млекопитающих и снижать выживаемость потомства особей, получавших достаточно большую дозу соланина.
![Рис. 10. Судьба пирролизидиновых алкалоидов в организме фитофагов А - в организме млекопитающих. Природный алкалоид (J) подвергается гидролизу с образованием ретронецина (retronecine) (2), который дегидратируется с образованием опасного токсина пиррола-1 (pyrrole-1) (3); последний связывается в печени; Б - в организме некоторых видов бабочек. Природный алкалоид подвергается гидролизу с образованием ретронецина (2), а затем пиррола-2 (4) и пиррола-3 (5), которые накапливаются в особом парном органе (hair pencils), расположенном латерально на конце брюшка самца (описаны у данаид) [Harborne, 1982]](pic/000027.jpg)
Рис. 10. Судьба пирролизидиновых алкалоидов в организме фитофагов А - в организме млекопитающих. Природный алкалоид (J) подвергается гидролизу с образованием ретронецина (retronecine) (2), который дегидратируется с образованием опасного токсина пиррола-1 (pyrrole-1) (3); последний связывается в печени; Б - в организме некоторых видов бабочек. Природный алкалоид подвергается гидролизу с образованием ретронецина (2), а затем пиррола-2 (4) и пиррола-3 (5), которые накапливаются в особом парном органе (hair pencils), расположенном латерально на конце брюшка самца (описаны у данаид) [Harborne, 1982]
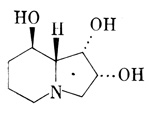
Рис. 11. Индолизидиновый алкалоид свайнсонин (swainsonine)
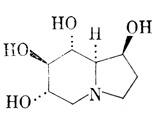
Рис. 12. Индолизидиновый алкалоид кастаноспермин (castanospermin)
7. Производные имидазола, например высокотоксичный м-холиномиметик (мускариномиметик) пилокарпин (из Pilocarpus pinna- tifolius Jaborandi, Южная Америка), применяемый в медицине при глаукоме.
8. Ациклические алкалоидные амины: эфедрин, антимитотические токсины колхицин и колхамин (из безвременника Colchicum spp.) и др. Колхамин применяется для лечения рака кожи.
9. Аконитовые алкалоиды, например обладающий курареподоб- ной активностью метилликаконитин (из живокости Delphinium spp.), используемый в медицине, и другие алкалоиды.
10. Пирролизидиновые алкалоиды (например, [Robins, 1985]). Некоторые бабочки, среди которых не менее 24 видов Danainae, [Ackery, Vane-Wright, 1984] используют пирролизидиновые алкалоиды для синтеза феромонов (см. разд. 5.1.1). Например, самцы бабочек данаид посещают растения из семейств бурачниковых и сложноцветных для получения этих алкалоидов. Из них в организме самцов вырабатываются ароматические вещества, привлекающие самок, например пиррол-2 и пиррол-3 (рис. 10).
Пирролизидиновые (и некоторые другие) алкалоиды накапливаются некоторыми растительноядными насекомыми. Накопление токсинов растений показано для более чем полутора сотен видов насекомых (чешуекрылые, сетчатокрылые, клопы, жуки, двукрылые, прямокрылые). Есть данные, что накапливаемые токсины защищают насекомых от хищников, как позвоночных, так и беспозвоночных, например пауков [Keith, 1984].
Накапливаться в насекомых могут и другие алкалоиды. Так, совка Heliothis zea способна накапливать алкалоид томата α-томатин, получаемый с пищей при кормлении на растениях томата. Этот алкалоид защищает ее от паразитоида Hyposoter exiguae (Viereck) (Hymenoptera), который используется как средство биологической борьбы с совкой [Campbell, Duffey, 1981]. Это же алкалоид, α-томатин, действует как моллюскоцид, убивая переносчика шистозомоза моллюска Biomphalaria glabrata при концентрации всего 4 млн-1 [Hostettmann et al., 1982].
Приведем другие примеры алкалоидов. В растениях найдены алкалоиды, которые близки по своей структуре некоторым сахарам [Fellows, 1987] и вследствие этого ингибируют ферменты, участвующие в метаболизме углеводов. Некоторые токсичные алкалоиды, такие, как свайнсоннн (swainsonine) из Swainsona sp. (рис. 11) и кастаноспермин (castanospermine) из Castanospermum australe
A. Cunn (рис. 12), проявили себе как перспективные вещества для исследования и лечения некоторых видов рака.
Дополнительная информация о токсичных или фагорепеллентных алкалоидах дана в работах [Robins, 1985; Pelletier, 1987].
Быстрое накопление новой информации об алкалоидах растений характеризует тот факт, что за 1 год выделяют одних только новых пирролизидиновых алкалоидов около 15 [Robins, 1985], апорфиноидных (aporphinoid) алкалоидов свыше 20 [Shamma, Guinaudeau, 1985]. Думается, что общее число ежегодно выделяемых новых алкалоидов растений по меньшей мере на порядок выше.
Пептиды. Примерами токсичных пептидов могут служить вискотоксин из омелы белой Viscnm album, а также некоторые токсины грибов (см. гл. 3).
Белки. Примерами токсичных белков являются лектины. В семенах африканского растения Abrus precatorius L. (сем. бобовые) содержится абрин (abrin). Летальная доза его для человека около 0,5 мг. Семена ярко окрашены, используются африканцами для изготовления украшений, и случаи отравления ими действительно зарегистрированы.
В семенах клещевины Ricinus communis L. содержится токсичный рицин (ricin).
Содержащиеся в семенах покрытосеменных другие лектины также могут быть токсичны для фитофагов (например, [Liener et al., 1986]). В семенах сои Glycine max (L.) Merr. и ряда других растений найдены белки - ингибиторы протеаз. Они могут снижать пищевую ценность семян для фитофагов.
Накапливаются новые данные о содержащих азот токсинах растений (табл. 17).
Токсины растений, не содержащие азот. В эту разнообразную группу токсинов входят соединения, относящиеся к различным по химизму классам веществ: гликозиды, сапонины, терненоиды, флавоноиды, хиноны, полиацетилены (полиины), пиретрины и др.
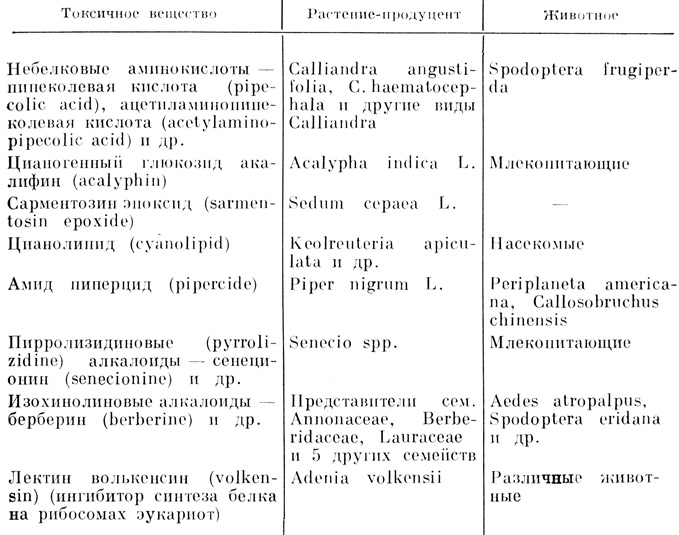
Таблица 17. Некоторые азотсодержащие вещества растений, токсичные для животных-фитофагов
А. Группа негликозидных токсинов. Простейшим примером может служить монофторуксусная кислота CH2FCО2H. Она встречается в некоторых южноафриканских растениях, например Dichapetalnm cymosum Engl. Этот яд ингибирует цикл Кребса. Для человека летальная доза 2-5 мг/кг веса тела.
Еще одним простым по структуре, но эффективным токсином оказался 2-тридекапон. Его пары высокотоксичны для тлей Aphis gossypii Glover, а также личинок табачного бражника Mandnca sexta (L.) и совок Heliothis zea (Boddie) [Jacobson, 1982]. Содержание 2-тридеканона в диком виде томата Lycopersicon hirsutum f. glabratum С. H. Mull, примерно в 70 раз превышает его концентрацию в тканях культивируемого томата L. esculentum Mill.
Большой группой веществ, среди которых есть токсичные (но чаще антифидантные и репеллеитные, см. разд. 4.1.3.) соединения, являются терненоиды (табл. 18). К ним относятся монотернены (более 1100), сесквитерпены (более 1300), дитерпены (более 1100).
Терпеноидные альдегиды, в том числе госсипол, участвуют в создании резистентности растений к нематодам [Hedin et al., 1984].
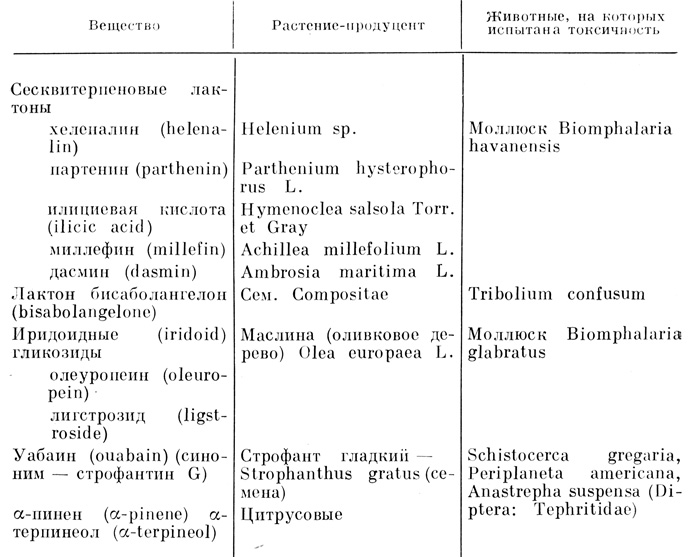
Таблица 18. Некоторые не содержащие азота вещества растений, токсичные для животных
К токсичным терпеиоидам относится целый ряд веществ, в том числе сапонины. Примером последних служит медикагеновая кислота из листьев Medicago sativa L. (люцерна). Она токсична для насекомых и рыб.
Терпен лимонен оказался эффективным инсектицидом против жуков Callosobruchus pliasecoli Gyli. (Taylor, Vickery, 1974; см. [Jacobson, 1982]).
Весьма интересная группа токсинов - многообразные форболовые эфиры растений семейств Euphorbiaceae и Thymelaeaceae. Эти вещества вызывают отравление выпасаемых домашних животных; они широко применяются при исследовании канцерогенеза. Биологическому действию форболовых эфиров посвящена большая литература.
Были обнаружены новые токсичные дитерпеновые эфиры в невысоком кустарниковом растении Pimelea prostrata Willd. (сем. Thymelaeaceae), эндемике Новой Зеландии. Эти вещества делают пимелею токсичной для домашнего скота. Среди этих токсичных веществ найдены производные тиглиана, дафнана и 1-а-алкил- дафнана. Вещества последней группы проявили себя как промоторы (promotors) раковой опухоли [Zayed et al., 1982]. Некоторые из этих веществ и близкие им по структуре соединения найдены у других растений из того же семейства, например в корнях не отропического кустарника Daphnopsis racemosa Griseb. [Adolf, Hecker, 1982].
Флавоноиды (более 1500-1600) широко распространены среди покрытосеменных, голосеменных папоротников и мхов; обладают чрезвычайно разнообразной биологической активностью. Многие флавоноиды представляют интерес с медицинской и ветеринарной точки зрения.
Представить флавоноидов - ротенон из корней Derris, Теphrosia и Lonchocarpus (сем. бобовые), токсичный для насекомых и рыб, ингибирует цепь переноса электронов в митохондриях и используется как пестицид; ротенон применяется в биохимии при исследовании биоэнергетики митохондрий. Ряд токсичных флавоноидов (например, рутин) выделен из томатов Lycopersicon esculenlnm Mill.; показана их токсичность для одного из вредителей томатов - совки Heliothis zea (Boddie).
Xиноны (более 550). Представитель хинонов - гиперицин из листьев зверобоя Hypericum perforatum, токсичный для млекопитающих.
Полиины, или полиацетилены (по-видимому, более 1700), встречаются у покрытосеменных (в том числе сем. Apiaceae и Asteraceae), а также у грибов. Некоторые из них токсичны и несут несколько экологических функций как аллелопатические вещества, стимуляторы овинозиции, фитоалексины.
Представители полиацетиленов - цикутотоксин из корней Cicuta virosa L. и энантетоксин из корней Oenanthe crocata L. (оба растения из сем. зонтичных), токсичные для млекопитающих.
Простые фенолы (более 200-220) обычны в растениях, имеют выраженную биологическую активность и несут, по-видимому, одновременно несколько экологических функций. Часто имеют антимикробную, антифидантную, аллелопатическую активность.
Среди других токсичных метаболитов растений обнаружены w-алкилфенолы, выделенные из латиноамериканского (Бразилия, Парагвай) лекарственного растения Schinus terebiiithifolius Raddi (Anacardiaceae) [Skopp et al., 1987]. Эти же вещества являются продуктами биодеградации в биосфере загрязняющих веществ, попадающих в экосистемы в составе некоторых детергентов. Ранее считалось, что к-алкилфенолы - типично антропогенные вещества. Теперь они обнаружены и как биогенные соединения.
Пиретрины (pyrethrins). Эти производные циклопропапкарбоновой кислоты из Chrysanthemum cinearifollum Vis. Известны инсектицидными свойствами с глубокой древности, когда применяли порошок из размолотых цветков растения-продуцента. Природная смесь пиретрииов состоит из шести веществ, представленных сложными эфирами хризантемовой или пиретриповой кислоты и алициклических кетоспиртов: пиретролона, жасмолопа и цинеролона [Мельников, 1987]. Экологически интересно, что ииретрипы - пример природных токсинов, в структуре которых запрограммирована способность быстро разлагаться в окружающей среде, т. е. та экологическая безвредность, к которой не всегда успешно стремятся создатели синтетических пестицидов. Под действием света боковая цепь хризантемовой кислоты окисляется с образованием нетоксичных соединений. Кроме того, спиртовая часть молекулы также имеет низкую фотохимическую стабильность и окисляется кислородом воздуха с утратой токсичных свойств.
Ценность пиретринов не только в том, что они применялись как инсектициды, но и в том, что они послужили моделью для синтеза в промышленных масштабах большого числа пестицидов - синтетических аналогов пиретринов (пиретроидов). Наиболее важный среди них - аллетрин и свыше 20 других препаратов [Мельников, 1987].
Растения могут поглощать и накапливать в своих тканях микотоксины, вырабатываемые почвенными грибами, и эти микотоксины становятся защитой от фитофагов.
Так, растение южноамериканской саванны Baccharis caridifolia DC. из сем. сложноцветных (называемое в Бразилии mio-mio, в Аргентине - romerillo) накапливает в своих тканях микотоксины из группы макроциклических трихотеценов (trichothecenes), которые, по-видимому, продуцирует почвенный гриб Myrothecimn verrucaria [Habermehl et al., 1985]. Среди девяти трихотеценов, найденных в тканях этого растения, описаны два новых токсина - миофито- цены (miophytocenes) А и В. Эти токсины имеют практическое значение, так как вызывают отравление пасущегося скота.
Среди микотоксинов экологически интересны и афлатоксины - афлатоксин В и другие, образуемые, например, грибом Aspergillus, flavus. Последний пример имеет прямое отношение к высшим растениям, поскольку этот гриб растет на арахисе - Arachis hypogea и других растениях. Можно предполагать, что растение благодаря наличию на них грибов может снижать пресс со стороны животных-фитофагов.
Б. Гликозиды и их экологическое значение для насекомых. Сердечные гликозиды (карденолиды, cardenolides) - ряд соединений, которые имеют стероидную структуру и обладают кардиотонической активностью. Их примерами служат дигитоксин, дигоксип, строфантин G (уабаин), олеандрин и многие другие. Они ингибируют мембранные АТФазы, оказывают мощное воздействие на обмен К+, Na+ и Са+ и на многие физиологические процессы.
Эти защитные вещества растений обладают большой мощью: об этом говорит, например, тот факт, что передозировка лекарств с сердечными гликозидами может привести к смерти пациента.
Гликозиды участвуют в следующей интересной системе взаимоотношений между растениями и животными [Rothschild, 1972; Harborne, 1982].
1. Ряд видов растений, например ваточник Asclepias curassavica L. и другие представители этого рода (сем. ластовневых Asclepiadaceae), а также олеандр Nerium oleander L. (сем. кутровых Ароcynaceae), образуют сердечные гликозиды, служащие пассивной; защитой от фитофагов.
2. Гусеницы нескольких видов бабочек данаид и некоторые другие насекомые приспособились накапливать гликозиды в своем организме. Упомянутые насекомые, питаясь токсичным для других видов кормом, избавляются от конкуренции со стороны других фитофагов.
3. Гусеницы превращаются в конце концов в имаго - бабочек,, которые сохраняют накопленные гусеницами сердечные гликозиды.
4. Насекомоядные птицы ловят бабочек; поскольку сердечные гликозиды имеют отталкивающий вкус, то при повторной ловле данаид у птиц вырабатывается отрицательный рефлекс на этих яркоокрашеиных бабочек.
Аналогичный механизм защищает и некоторых других насекомых, живущих на ваточнике Asclepias, в том числе некоторых клопов лигеид, кузнечиков пиргоморфид, жуков и тлей.
Интересно, что бабочки данаиды зависят от двух групп веществ,, вырабатываемых растениями: сердечных гликозидов и пирролизидиновых алкалоидов. Эти две группы веществ вырабатываются растениями разных семейств, что делает экологию межвидовых связей довольно сложной: сердечные гликозиды этим бабочкам надо получать от растений семейств ластовневых и кутровых, а алкалоиды - от растений семейств бурачниковых и сложноцветных.
Хотя сердечные гликозиды всегда привлекали большое внимание исследователей и сравнительно хорошо изучены, но до сих пор публикуются сообщения об открытии новых веществ этого класса. Например, сравнительно недавно исследователи Венского- университета открыли сразу 10 новых карденолидов в таком, казалось бы, хорошо изученном растении, как ландыш Convallaria majalis L., причем впервые в составе сердечных гликозидов обнаружен остаток сравнительно редкого сахара - аллозы [Коррг Kubelka, 1982]. Этот пример еще раз подчеркивает недостаточную изученность и богатство мира вторичных метаболитов, скрытого в живых организмах.
Общее количество карденолидов с установленной структурой к началу 80-х годов составляло по некоторым данным около 150 [Harborne, 1982]. Однако, по-видимому, сейчас эту цифру можно увеличить примерно вдвое или более. Точное число назвать невозможно не только по причине обнаружения новых сердечных гликозидов, но и вследствие высокой лабильности исходных, нативных гликозидов. Эти первичные гликозиды, называемые в фармакологии генуинными (от греческого γενος - генос - рождение, происхождение), легко подвергаются энзиматическому и неэнзиматическому гидролизу в период хранения и обработки растительного сырья. Один первичный гликозид, последовательно утрачивая остатки сахаров, может давать целый ряд вторичных гликозидов.
Так, упомянутый выше дигоксип, перспективный для биотехнологического производства ввиду высокой цены - около 3000 долл, за 1 кг (1986 г.), является вторичным гликозидом, продуктом гидролиза первичного гликозида пурпуреагликозида В. Дигитоксин, олеандрин, β-строфантин К, конваллятоксин и другие известные в фармакологии вещества также являются продуктами гидролиза первичных гликозидов.
Некоторые гликозиды, относящиеся к сапонинам, токсичны для животных. Показана токсичность некоторых сапонинов для моллюсков, насекомых, рыб, амфибий [Price et al., 1987].
Биологической активностью обладают и многие другие гликозиды, в том числе иридоидные (распространенные у растений не менее 6 семейств), тритерпеновые (описано более 200 таких гликозидов из растений многих семейств), флавоноидные и др
Воздействие экологических факторов на содержание в растениях токсинов. Ряд экологических факторов воздействует на сопротивляемость растений к фитофагам.
Так, на содержание в тканях растений токсичных для фитофагов веществ может оказывать решающее влияние такой экологический фактор, как длина светового дня.
Такое влияние установлено для одной из линий дикого томата Lycopersicon hirsutum f. glabratum G. H. Mull, устойчивой к бражнику Manduca sexta (L.). Если растения эквадорской линии PI 134417 выращивали в условиях длинного светового дня, то в их листьях содержалось гораздо больше токсина 2-тридеканона и смертность личинок бабочек, выращиваемых на этих листьях, была значительно выше. При высокой интенсивности освещения увеличение светового дня приводило к удвоению числа железистых волосков, секретирующих 2-тридеканоп, на единицу поверхности листа. Установлено также, что длина светового дня наряду с возрастом растений влияет на химические основы устойчивости данной линии к колорадскому жуку Leptinotarsa decemlineata (Say). Отмеченные явления могут иметь практическое значение при оптимизации режима выращивания растений в условиях тепличного хозяйства.
Кроме вторичных метаболитов и белков, вклад в резистентность растений к насекомым могут вносить токсичные для них гетерополисахариды, как показано для гетерополисахаридной фракции Phaseolus vulgaris L., на которую приходится около 4% всех семян [Gatehouse et al., 1987].
Некоторые из представителей рассмотренных выше метаболитов растений уже стали объектами биотехнологического синтеза, а клетки растений-продуцентов культивируются в биореакторах различного типа [Petiard, Steck, 1987].
Интересная дополнительная информация о токсичных веществах растений, их роли и метаболизме приведена во многих работах (например, [Keeler, Tu, 1983; Klecke et al., 1985; Dalvi, Jones, 4986; Andersen et al., 1988]).
© ECOLOGYLIB.RU, 2001-2020
При использовании материалов сайта активная ссылка обязательна:
http://ecologylib.ru/ 'Зелёная планета - экология и охрана природы'
При использовании материалов сайта активная ссылка обязательна:
http://ecologylib.ru/ 'Зелёная планета - экология и охрана природы'