ПОИСК:

5.2.1. Алломоны
К алломонам во взаимодействиях животных разных видов относятся прежде всего различные токсины и отпугивающие вещества. Токсичные алломоны могут служить и средством агрессии (у хищных животных, например у ядовитых змей, некоторых хищных моллюсков и кишечнополостных), и средством защиты от нападения хищных или потенциально хищных видов. Тем самым токсичные алломоны выполняют важную роль для конкретных отдельных видов (способствуя их выживанию) и для сообщества в целом (регулируя специфику трофических цепей и скорость переноса энергии по ним). Последнее дает право относить эти алломоны к широкой категории веществ, являющихся экологическими хеморегуляторами.

Таблица 36. Состав яда пчелы медоносной Apis mellifera
![Таблица 37. Примеры алломонов водных беспозвоночных (по [Wright, 1984; и др.])](pic/000069.jpg)
Таблица 37. Примеры алломонов водных беспозвоночных (по [Wright, 1984; и др.])
Описано множество токсинов и репеллентных веществ [Blum, 1981; и др.] у беспозвоночных (табл. 36-38, рис. 29-31) и позвоночных животных, включая рыб, амфибий, рептилий и млекопитающих (см. табл. 39). По-видимому, к числу наиболее токсичных для позвоночных ядов, вырабатываемых беспозвоночными, относятся яды некоторых кишечнополостных. ЛД50 для млекопитающих составляет всего лишь 0,1 мкг/кг в случае токсина из кишечнополостного Chironex fleckeri [Tu, 1982] и 0,15 мкг/кг для палитоксина из кишечнополостного Palythoa.
Палитоксин крайне интересен по своей химической структуре (см. рис. 29). Расшифровка строения этой молекулы, содержащей 64 асимметрических центра, представляла немалые трудности. По своей величине молекула палитоксина занимает промежуточное положение между низко- и высокомолекулярными соединениями [Naylor, 1984]. Можно сказать, что палитоксин является одним из первых примеров пока малоизученного класса мезомолекулярных соединений.
Интересным высокотоксичным алломоном насекомых является полипептид с молекулярной массой 60 000, обнаруженный в 1983 г. в куколках африканского жука Diamphidia nigro-ornata и названный поэтому диамфотоксином. Это насекомое и его алломон привлекли внимание исследователей потому, что бушмены, населяющие пустыню Калахари и прилегающий регион саванны Северо-Западной Ботсваны, делают из экстракта куколок этого вида яд для своих стрел. Экстракт из 4-5 куколок используется для подготовки дюжины стрел, каждая из которых способна убить взрослого жирафа весом более полутонны. Минимальная летальная доза для мышей составляет 25 пг (25-10-12 г), т. е. менее 0,5×10-15 моль. Гемолитическая активность токсина очень высока: для гемолиза эритроцитов овцы в стандартных условиях достаточно 65 молекул токсина на 1 клетку [Harpe et al., 1983].
Ежегодно описываются новые и новые алломоны (например, рис. 30, 31).
Большое количество разнообразных новых алломонов находят, в частности, у морских беспозвоночных, в том числе у губок. Одним из примеров может служить сравительно простое вещество морских губок Alcyonidium gelatinosum, вызывающее контактный Дерматит [Wright, 1984]:
![Рис. 29. Примеры алломонов морских беспозвоночных 1 9-изоцианопунукеанан (9-isocyanopupukeanane) из губки Hymeniacidon sp. и моллюска Phyllidia varicosa; 2 - накафуран-8 (nakafuran-8) из губки Dysidea и моллюска Hypselodoris sp.; 3 - изонитрил (isonitrile) (а) и изотиоцианат (isothiocyanate) (б) из губ Axinella sp. и голожаберного моллюска Cadlina luteomarginata; 4 - изодизеденин (isodysedenin) из губки Dysidea herbacea; 5 - пацифигоргиол (pacifigorgiol)из нескольких видов кораллов; 6 - лофотоксин (lophotoxin); 7 - холотоксин A (holotoxin А) из Морского огурца Stichopus japonicus; 8 - палитоксин (palytoxin) из Palythoa sp. Вещества 1, 2 и 3 обнаружены и в губках, и в голожаберных моллюсках [Naylor, 1984]](pic/000073.jpg)
Рис. 29. Примеры алломонов морских беспозвоночных 1 9-изоцианопунукеанан (9-isocyanopupukeanane) из губки Hymeniacidon sp. и моллюска Phyllidia varicosa; 2 - накафуран-8 (nakafuran-8) из губки Dysidea и моллюска Hypselodoris sp.; 3 - изонитрил (isonitrile) (а) и изотиоцианат (isothiocyanate) (б) из губ Axinella sp. и голожаберного моллюска Cadlina luteomarginata; 4 - изодизеденин (isodysedenin) из губки Dysidea herbacea; 5 - пацифигоргиол (pacifigorgiol)из нескольких видов кораллов; 6 - лофотоксин (lophotoxin); 7 - холотоксин A (holotoxin А) из Морского огурца Stichopus japonicus; 8 - палитоксин (palytoxin) из Palythoa sp. Вещества 1, 2 и 3 обнаружены и в губках, и в голожаберных моллюсках [Naylor, 1984]
![Рис. 30. Алломоны морских беспозвоночных 1 - стеринсульфаты (sterol sulphates) морских губок Toxadocia zumi (токсичны для рыб и микроорганизмов): 2 - латрунрункулины (latrunculins) морских губок Latruncula magnifica (токсичны для рыб): 2а - латрункулин А, 26 - латрункулин Б; 3 - аксизо-нитрил-1 (axisonitrile-1) - изоцианосесквитерпен (isocyanosesquiterpene) голожаберного моллюска Phyllidia pulitzeri и его жертвы - губки Axinella cannabina (токсичен для рыб): 4 - полигодиаль (polygodial) из голожаберного моллюска Dendrodoris limbata (ингибитор питания рыб); 5 - сестертерпены губки Cacospongia mollior: 5а - скаларадиаль (scalaradial), 5б - фуроскаларол (furoscalarol), содержится также в голожаберном моллюске Glossodoris tricolor, который поедает губок данного вида, 5в - деоксоскаларин (deoxoscalarin), содержится в обоих организмах; все три сестертерпена ингибируют питание рыб [Nakatsu et al., 1983; Groweiss et al., 1983; и др.]](pic/000072.jpg)
Рис. 30. Алломоны морских беспозвоночных 1 - стеринсульфаты (sterol sulphates) морских губок Toxadocia zumi (токсичны для рыб и микроорганизмов): 2 - латрунрункулины (latrunculins) морских губок Latruncula magnifica (токсичны для рыб): 2а - латрункулин А, 26 - латрункулин Б; 3 - аксизо-нитрил-1 (axisonitrile-1) - изоцианосесквитерпен (isocyanosesquiterpene) голожаберного моллюска Phyllidia pulitzeri и его жертвы - губки Axinella cannabina (токсичен для рыб): 4 - полигодиаль (polygodial) из голожаберного моллюска Dendrodoris limbata (ингибитор питания рыб); 5 - сестертерпены губки Cacospongia mollior: 5а - скаларадиаль (scalaradial), 5б - фуроскаларол (furoscalarol), содержится также в голожаберном моллюске Glossodoris tricolor, который поедает губок данного вида, 5в - деоксоскаларин (deoxoscalarin), содержится в обоих организмах; все три сестертерпена ингибируют питание рыб [Nakatsu et al., 1983; Groweiss et al., 1983; и др.]
Ташкентские исследователи М. У. Туйчибаев и Б. А. Ташмухамедов [1984] совместно с ленинградскими учеными из Института эволюционной физиологии и биохимии выделили из яда большого шершня Vespa orientalis новый нейротоксин - белок, названный ими ориентотоксином. Этот токсин обладает лизофосфолипазной активностью и блокирует выделение нейромедиатора из пресинаптических мембран.
Яд некоторых перепончатокрылых, например пчел (табл. 36), подробно изучен.
![Рис. 31. Защитные вещества насекомых [Chuan et al., 1983; Jafson et al., 1983] 1 - тринервита-1 (15),8 (19)- диен-2β, 3α-диол (trinervita- 1 (15),8(19)-dien-2β, 3α-diol), из основных компонентов защитного секрета солдат малазийского термита Hos- pitalitermes umbrinus; 2 - защитные вещества личинок жука Pyrrhaita luteola; 2а, 26 - антрахиноны (anthra- quinones), 2в, 2г - антроны anthrones); 3 - защитные вещества жука стафилины Creophilus maxillosus: 3ф - изоамилацетат (isoamyl acetate), 3б - иридодиаль (iridodial), 3в - дигидронепета- лактон (dihydronepetalacto- пе), 3г - (Е)-8-оксоцитронеллилацетат (oxocitronellyl acetate)](pic/000074.jpg)
Рис. 31. Защитные вещества насекомых [Chuan et al., 1983; Jafson et al., 1983] 1 - тринервита-1 (15),8 (19)- диен-2β, 3α-диол (trinervita- 1 (15),8(19)-dien-2β, 3α-diol), из основных компонентов защитного секрета солдат малазийского термита Hos- pitalitermes umbrinus; 2 - защитные вещества личинок жука Pyrrhaita luteola; 2а, 26 - антрахиноны (anthra- quinones), 2в, 2г - антроны anthrones); 3 - защитные вещества жука стафилины Creophilus maxillosus: 3ф - изоамилацетат (isoamyl acetate), 3б - иридодиаль (iridodial), 3в - дигидронепета- лактон (dihydronepetalacto- пе), 3г - (Е)-8-оксоцитронеллилацетат (oxocitronellyl acetate)
Развитие аквакультуры делает особенно важным познание токсинов, содержащихся в гидробионтах (табл. 37) и особенно объектах аква- и марикультуры, в том числе в моллюсках.
В 1965 г. в Японии были зарегистрированы пищевые отравления моллюсками Babylonia japonica, которых вылавливали в заливе Suruga Вау. Из пищеварительной железы моллюсков были выделены суругатоксин (surugatoxin), неосуругатоксин (neosuruga- toxin) и просуругатоксин (prosurugatoxin), имеющие избирательное сродство к никотиновым рецепторам. Суругатоксин был оонаружен в культурной среде коринеформных бактерий, выделенных из пищеварительной железы этих моллюсков, что указывает на бактериальное происхождение токсинов этой группы [Kosuge ct al., 1987].
Все три токсина содержат бром, являя собой примеры природных галогенсодержащих органических веществ.
Немалое число человеческих жизней унес тетродотоксин (ТТХ) рыб семейства иглобрюхих (синонимы - сем. скалозубовых, или рыбы-собаки) Tetraodontidae. Из этих рыб готовят знаменитое и почитаемое в восточных странах блюдо "фугу". Тетродотоксин 1рис. 32) обнаружен также у саламандр Tariche torosa и у костариканской лягушки Atelopus sp. Это вещество найдено и у беспозвоночных животных. Так, осьминог Hapalochlaena maculosa выделяет его, иммобилизуя свою добычу [Naylor, 1984].
Тетродотоксин обнаружен в тканях ряда других беспозвоночных, в том числе крупного моллюска Charonia sauliae (Gastropoda), Употребляемого в Японии в пищу, в морских звездах Astropecten polyacanthus ("togemomijigai") и Astropecten scoparius ("momiji- gai") [Maruyama et al., 1985], в крабах Atergatis floridus и Zosimus aeneus (см., например, [Yasumoto et al., 1986]). Предполагают, что в организм крабов, а также таких растительноядных рыб, как Scarus gibbus, ТТХ попадает вместе с красной водорослью Jania sp. [Yasumoto et al., 1986]. Получены данные, что ТТХ и ангидротетродотоксин (ангид-ТТХ) могут накапливаться в культуре бактерий Pseudomonas sp., изолированной из водоросли Jania sp., т. е. эти токсины могут иметь первоначально бактериальное происхождение и затем переноситься в высшие организмы по трофическим цепям [Yasumoto et al., 1986].

Таблица 38. Алломоны (токсины, защитные вещества) некоторых насекомых
В рыбах найдены и другие токсины, некоторые из которых близки ТТХ, но не идентичны ему (например, [Inaoka et al., 1985]).
Тетродотоксин сыграл большую роль в изучении переноса ионов через биомембраны, поскольку он подавляет перенос ионов натрия через мембраны нервных и мышечных клеток.
Практический интерес могут представлять репеллентные и токсичные вещества, отпугивающие хищников и образуемые так называемыми ихтиокринотоксичными (ich thy ocrinotoxic) рыбами. В 1984 г. из выделений рыбы Pardachirus pavoninus выделены ихтиотоксичные и гемолитические стероидные аминогликозиды павонинины 1-6 (pavoninins - 6), которые эффективно отпугивали акул Mustelusgriseus и Negaprion brevirostris [Tachibana et al., 1984] (рис. 33).
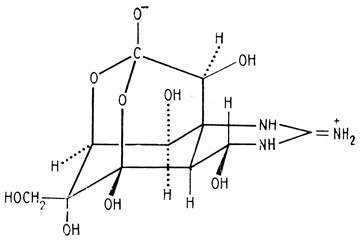
Рис. 32. Тетродоксип
Среди алломонов позвоночных (см. табл. 39) особый интерес представляют токсины змеи, в составе которых обнаружены сложнейшие комплексы биологически активных веществ, в том числе пре- и постсинаптические токсины, кардио- и миотоксины, геморрагические токсины и протеолитические ферменты (эти факторы относятся к высоколетальным) и др. Среди прочих относительно нелетальных факторов, найденных в яде змей, содержатся следующие: гемолитический фактор, фосфолипазы, антикоагулянты, прокоагулянты, факторы роста нервных клеток, антикомплементарные факторы, целый ряд других ферментов - фосфодиэстеразы, фосфомоноэстеразы, оксидаза 1-аминокислот, ацетилхолинэстераза, аргининэфиргидролаза, гиалуронидаза, НАД-нуклеозидаза и т. д. Среди протеолитических ферментов в яде змей обнаружены эндопептидаза и экзопептидаза; найдены коллагеназа, эластаза, тромбиноподобный фермент и др.

Таблица 39. Примеры алломонов позвоночных
Установлена первичная структура не менее 150 белковых токсинов, по-видимому, не менее 40-50 видов и подвидов змей [Наbermehl, 1983; Nishiuchi, Sakakibara, 1982; и др.). Среди них свыше 60 нейротоксинов, около 50 кардиотоксинов (цитотоксинов, факторов с прямым литическим действием, активных по отношению к различным клеточным мембранам), не менее 8 фосфолипаз А и 7 ингибиторов протеаз; несколько токсинов действуют на натриевый канал биомембран [Habermehl, 1983; Breckenridge, Dufton, 1987 ].
![Рис. 33. Ихтиотоксичные павонинины - павонинин-1 и павонинин- 2 рыб Pardachirus marmoratus, отпугивающие акул [Tachibana et al., 1984]](pic/000078.jpg)
Рис. 33. Ихтиотоксичные павонинины - павонинин-1 и павонинин- 2 рыб Pardachirus marmoratus, отпугивающие акул [Tachibana et al., 1984]
Токсинам животных посвящено очень много работ. Большое число работ содержит дополнительную информацию об алломонах водных, особенно морских животных [Schulte, Scheuer, 1982 (весь номер этого журнала - об алломонах животных); Cimino et al., 1982; De Napoli et al., 1984; Fraga, 1985; Mebs, 1985; Ozaki et al., 1985; Bakus et al., 1986; Muller et al., 1986; Ohizumi, 1987; Marcum, 1987]. Многие работы содержат дополнительные сведе- ния об алломонах наземных беспозвоночных [Листов 1982 1989- Kojima, 1983; Tu, 1984; Meinwald et al., 1987; Braekman 'et al., 1987] и позвоночных [Habermehl, 1983; Daly, Spande, 1986; Daly et al., 1987].
Суммируя известные факты об алломонах, можно сделать следующие обобщения.
1. В качестве токсинов и репеллентов используются вещества многих классов, от низкомолекулярных (хиноны, амины, терпеноиды) до высокомолекулярных (пептиды и белки).
2. Довольно широко распространены случаи, когда химическим оружием данного вида является целый комплекс веществ (например, см. рис. 31), иногда близких по химической природе, иногда совершенно различных.
3. Установлены случаи, когда одно и то же вещество используется как химическое оружие двумя или несколькими неблизкородственными видами.
4. У некоторых видов животных описано накопление токсичных веществ, полученных из организмов, служащих для этих видов пищей. Это явление имеет место и у наземных, и у водных беспозвоночных. Примеры такого повторного использования токсичных или антифидантных веществ приведены в табл. 38 и на рис. 30.
О широком распространении у насекомых способности накапливать из растительной пищи токсичные вещества говорит обнаружение у саранчового Romalea microptera 2,5-дихлорфенола; источником последнего являются, как полагают, гербициды (Eisner et al., 1971; см. [Барбье, 1978]).
К числу алломонов можно отнести еще некоторые другие экологические хеморегуляторы.
Сюда можно включить группу веществ с несколькими функциями, выделяемых некоторыми жуками, обитающими на хвойных деревьях. Эти вещества могут нести две функции: 1) передачи сигнала для жуков того же вида, т. е. функции феромона, и 2) нарушения сигнальной коммуникации у жуков конкурирующего вида. Такой тип взаимодействий обнаружен у жуков Ips pini и I. раrаconfusus, обитающих на сосне Pinus ponderosa Laws (Light, Birch, 1979; см. [Остроумов, 1986]).
Еще одна группа алломонов - различные приманки. Недавно было высказано предположение, что роль приманки для муравьев Lasius niger может выполнять трисахарид мелезитоза, образуемый равнокрылыми [Kiss, 1981]. Поскольку муравьи защищают равнокрылых от хищников и паразитов, то такое привлечение выгодно видам равнокрылых, продуцирующим мелезитозу.
Изучение алломонов животных имеет практическое значение, связанное со следующими областями деятельности.
1. Медицина и биотехнология. Токсины некоторых животных служат как ценнейший источник получения фармакологически важных веществ, в том числе белков и пептидов. На основе токсинов готовятся некоторые сильнодействующие лекарства. Яды змей - одна из статей экспорта биотехнологических препаратов из СССР.
2. Сельское хозяйство. Оказалось, что некоторые аналоги природного токсина морских беспозвоночных - нереистоксина - являются высокоэффективными инсектицидами. К ним относятся два препарата - эвисект (тиоциклам) и банкол. Практически ценно, что оба этих препарата токсичны для такого опасного фитофага, как колорадский жук, причем они действуют и на такие расы колорадского жука, которые устойчивы к фосфорорганическим пестицидам (Трапов, Мельников, 1983; см. [Остроумов, 1986; Мельников, 1987]).
3. Научные исследования. Некоторые токсины животных оказались незаменимыми инструментами для исследования механизмов проведения нервного импульса и транспорта ионов через мембраны (например., [Ozaki et al., 1985; Ohizumi, 1987]). К числу токсинов, интересных для нейрохимии, относятся тетродотоксин, батрахотоксин, токсины змей, пауков (например, латротоксин), скорпионов, перепончатокрылых, некоторых морских беспозвоночных (например, палитоксин трансформирует натриевую помпу мембран эритроцитов в небольшие поры, проницаемые для ионов натрия, калия и холина).
4. Борьба с растительноядными позвоночными и грызунами. Идентифицирована структура некоторых серосодержащих одорантов, содержащихся в фекалиях хищных животных и вызывающих стресс у их потенциальных жертв. Так, стресс у подопытных крыс индуцировали обнаруженные в фекалиях лисиц 2,5-дигидро-2,4,5- триметилтиазол и 3,3-диметил-1,2-дитиолан [ Vernet-Maury et al., 1984]. Вместе с тем в фекалиях и моче лисиц идентифицировано не менее четырех серосодержащих одорантов, не вызывающих стресса у крыс.
Стресс-индуцирующие одоранты могут выполнять функцию алломонов для воспринимающих их животных - потенциальных жертв. Эти же вещества (и синтезированные соединения с аналогичным действием) могут использоваться в качестве репеллентов для борьбы с грызунами, в частности с крысами.
Хемосигналы мочи рыси (Felislynx и F. rufus), волка, койота и некоторых других хищников, нанесенной на побеги ивы и хвойных, снижали повреждение растений американским зайцем-беляком (Lupus americanus) [Sullivan et al., 1985а]. Сходным образом хемосигналы экскрементов хищников (рыси, волка, койота) подавляли пищевую активность другого растительноядного - чернохвостого оленя Odocoileus hemionus columbianus [Sullivan et al., 1985b],
© ECOLOGYLIB.RU, 2001-2020
При использовании материалов сайта активная ссылка обязательна:
http://ecologylib.ru/ 'Зелёная планета - экология и охрана природы'
При использовании материалов сайта активная ссылка обязательна:
http://ecologylib.ru/ 'Зелёная планета - экология и охрана природы'