ПОИСК:

Глава 4. Основные процессы в технологии приготовления питьевой опресненной воды
Охлаждение дистиллята. На опреснителях морской воды из концевого конденсатора в приемный резервуар поступает дистиллят с температурой 42-48°С и более. Предварительное охлаждение дистиллята осуществляют в напорных трубчатых теплообменниках. В качестве хладагента используют исходную морскую воду, которая имеет более низкую температуру. Например, морская вода в районе г. Шевченко даже летом имеет температуру 13-15°С. Более стабильный температурный режим имеют подземные воды и в том числе грунтовые неглубокого залегания. В теплообменнике дистиллят проходит по трубкам, а хладагент - в межтрубном пространстве. Теплообменные трубки применяют из коррозионно-стойких конструкционных материалов (нержавеющая сталь, сплавы на медной основе и т. п.).
Тепловая энергия в потоке жидкости передается конвекцией как внутри трубок, так и в межтрубном пространстве. Благодаря конвекции в процесс теплообмена включается вся масса каждой жидкости, т. е. хладагента и опресненной воды. Передача теплоты через стенку трубок происходит вследствие теплопроводности конструкционного материала (металла).
В общем виде количество теплоты d QT, проходящее через элементарную площадь стенки трубки dF за промежуток времени τ, определяют по формуле*
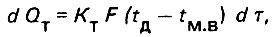 (4.1)
(4.1)где tд - температура дистиллята; KТ - коэффициент теплопередачи; tм.в - температура морской воды.
* (А. Г. Касаткин. Основные процессы и аппараты химической технологии.- М.: Госхимиздат, 1955.)
При параллельном токе обеих жидкостей: дистиллята:
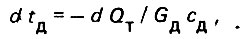 (4.2)
(4.2)где GД - количество дистиллята; сд - удельная теплоемкость дистиллята; морской воды:
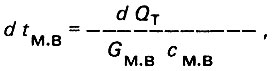 (4.3)
(4.3)где Gм.в - количество морской воды; см.в - удельная теплоемкость морской воды.
Произведения GДсд и Gм.вcм.в принято именовать водяным эквивалентом. Обозначим
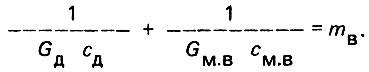 (4.4)
(4.4)Тогда
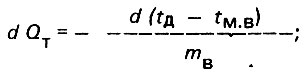 (4.5)
(4.5)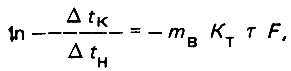 (4.6)
(4.6)откуда
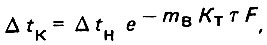 (4.7)
(4.7)где Δtн = tд.н - tм.в.н - начальная разность температур; Δtк = tд.к - tм.в.к - конечная разность температур.
Средний температурный напор равен
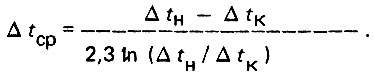 (4.8)
(4.8)Расчетное выражение теплопередачи будет
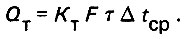 (4.9)
(4.9)В случае противотока в теплообменнике расчетные зависимости (4.8) и (4.9) сохраняются, а величина dtм.в будет отрицательной
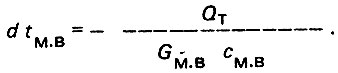 (4.10)
(4.10)В этом случае:
 (4.11)
(4.11)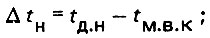 (4.12)
(4.12)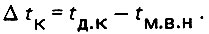 (4.13)
(4.13)Расчетные значения параметров Сд, См.в и Кт берут по теплотехническому справочнику. Если теплообменник будет громоздким при охлаждении дистиллята в одну ступень, то рекомендуется осуществлять двухступенчатую схему с соответствующими значениями среднего температурного напора Δtcp1, и Δtcp2. Суммарное значение указанных температурных напоров будет равно общему среднему температурному напору
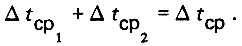 (4.14)
(4.14)Противоточное движение дистиллята в трубках и морской воды в межтрубном пространстве предпочтительнее по сравнению с параллельным током в трубчатых теплообменниках. Повышение эффективности теплообменников достигается различными способами, а именно: изготовлением теплообменных трубок из сплавов на медной основе, обладающих более высокой способностью теплопередачи: увеличением площади поверхности контакта металла с жидкостью путем профилирования сечения трубок и в частности устройства продольных ребер на поверхности трубок и применением специальных витых теплообменных трубок, обеспечивающих турбулизацию движения жидкости как внутри трубок, так и в межтрубном пространстве. Максимальный эффект может быть получен при применении витых теплообменных трубок, изготовленных из качественного теплопроводного сплава. Ребристые трубки получили широкое распространение на производстве и в коммунальном хозяйстве. Освоено также производство профилированных и витых трубок для нужд теплоэнергетики и химической технологии.
Механическая очистка дистиллята. В промышленном дистилляте могут присутствовать механические примеси: продукты коррозии металла, карбонатные и другие вещества. Из продуктов коррозии металла чаще всего присутствуют гидрокомплексы железа FenОm*K H2O. Очистку дистиллята от взвешенных веществ осуществляют путем фильтрования его через слой зернистой загрузки (чаще всего кварцевого песка). Адсорбция взвешенных частиц происходит главным образом под действием адгезии. По Д. М. Минцу* равновесие процесса можно описать следующим образом:
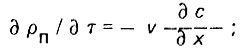 (4.15)
(4.15)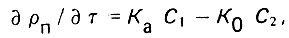 (4.16)
(4.16)где рп - плотность насыщения; Ка - коэффициент адгезии; K0 - коэффициент отрыва частиц; С1 и С2 - коэффициент взвешенных веществ в жидкой и твердой фазах.
* (Минц Д. М. Теоретические основы технологии очистки воды.- Стройиздат, 1964.)
В предельном состоянии насыщения слоя адсорбента
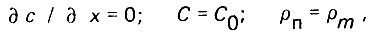
где рm - предельная плотность насыщения.
Параметры С и р связаны между собой следующим функциональным выражением:
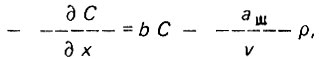 (4.17)
(4.17)где аш и b - параметры фильтрования.
В начале процесса р = 0 и
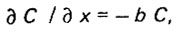 (4.18)
(4.18)откуда
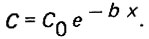 (4.19)
(4.19)В процессе фильтрования концентрация взвешенных веществ в жидкой фазе убывает по уравнению
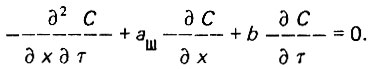 (4.20)
(4.20)Плотность насыщения слоя адсорбента взвешенными веществами возрастает по уравнению
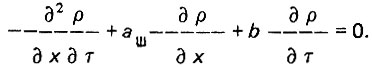 (4.21)
(4.21)Уравнения (4.20) и (4.21) могут быть решены с применением бесселевых функций в зависимости от обобщенных параметров X = bx и T = dш = т. Более простое решение предложено О. И. Мартыновой и А. А. Громогласовым в следующем виде:
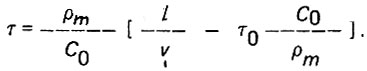 (4.22)
(4.22)По мере накопления взвешенных веществ на поверхности зерен адсорбента проходное сечение пор существенно уменьшается и, как следствие этого, возрастает гидравлическое сопротивление всего слоя в целом. При достижении предельно допустимого перепада давления в фильтрующем слое адсорбента подачу воды прекращают и адсорбционный слой промывают обратным током очищенной воды. В восходящем потоке слой адсорбента расширяется и интенсивно взрыхляется. При этом взвешенные частицы под действием касательных напряжений отрываются от поверхности зерен адсорбента и выносятся из фильтра вместе с промывной водой. При незначительном содержании взвешенных веществ в дистилляте фильтроцикл по потере напора оказывается достаточно продолжительным. В этом случае наблюдается биологическое загрязнение слоя адсорбента, а следовательно, и фильтрата по бактериологическим показателям. Во избежание этого продолжительность фильтроцикла ограничивают 7-8 сут, после чего фильтр выключают на промывку и обработку хлорной водой (5-10 Сl2г/л) при часовом контакте активного хлора с зернами адсорбента. После хлорной обработки фильтрующий слой адсорбента отмывается прямым током очищенной воды до получения чистого фильтрата с остаточной концентрацией хлора 0,2-0,3 мг/л.
Для аппаратов с зернистой загрузкой характерны два гидравлических режима работы: первый - фильтрование воды через неподвижный слой зернистой загрузки и второй - движение воды через подвижный слой загрузки, который расширяется и интенсивно взрыхляется. Судя по поведению зерен загрузки, указанные режимы отличаются друг от друга. Представляет интерес изменение критерия Рейнольдса при переходе от первого режима движения ко второму режиму. Для наглядности предположим, что при фильтровании воды и взрыхлении загрузки движение жидкости через слой загрузки происходит в одном направлении (снизу вверх). Численное значение критерия Рейнольдса можно определить по формуле:
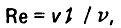 (4.23)
(4.23)где v - средняя составляющая скорости движения воды в слое загрузки; I - характерный линейный параметр; υ - кинематическая вязкость.
В данном случае как при фильтровании опресненной воды, так и при взрыхлении водой слоя загрузки параметр v изменяется незначительно. В качестве линейного параметра можно принять гидравлический радиус живого сечения порового канала (плоская задача)
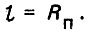 (4.24)
(4.24)При фильтровании воды зерна касаются друг друга, а гидравлический радиус порового канала Rn1 имеет минимальное значение. При взрыхлении слоя загрузки зерна отдаляются друг от друга, а гидравлический радиус Rn2 возрастает. При наличии неоднородного слоя загрузки, очевидно, следует принимать эквивалентное значение гидравлического радиуса живого сечения поровых каналов. Так как Rn2>Rn1, то, следовательно, имеем
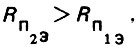 (4.25)
(4.25)При фильтровании воды в направлении снизу вверх допустимая скорость должна быть меньше критического значения, при котором нарушается спокойное состояние зерен загрузки. При взрыхлении слоя загрузки в том же направлении скорость должна быть больше критического значения. Так как v1<vкр, a v2> vкр, то
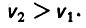 (4.26)
(4.26)Для первого режима фильтрование воды происходит в направлении снизу вверх
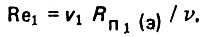 (4.27)
(4.27)Для второго режима взрыхление загрузки при движении воды осуществляют в том же направлении
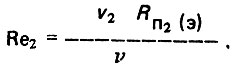 (4.28)
(4.28)
При 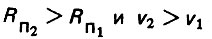

Следовательно, при переходе от фильтрования воды в неподвижном слое загрузки к движению ее во взвешенном слое загрузки критерий Рейнольдса для восходящего потока смещается в область более высоких значений.
При движении жидкости через слой неподвижной загрузки в направлении сверху вниз зерна находятся в устойчивом состоянии в широком диапазоне скоростей. В этом случае допустимую скорость фильтрования устанавливают либо по потере напора, либо по проскоку лимитирующего компонента загрязнений.
В общем случае, по Н. Н. Павловскому, движение вязкой несжимаемой жидкости в слое загрузки описывается критериальным уравнением вида
 (4.30)
(4.30)где ηc - коэффициент гидравлического сопротивления.
Коэффициент гидравлического сопротивления в переходной области зависит от критерия Рейнольдса следующим образом:
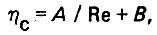 (4.31)
(4.31)где А и В - параметры процесса.
При переходе в ламинарную область движения жидкости в пористой среде В→0, а в турбулентную А→0, Для ламинарного движения жидкости А = 5,1, а для турбулентного В = 0,1. Указанные значения А и В получены для шарообразных частиц. При неправильной форме зерен
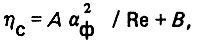 (4.32)
(4.32)где aф - коэффициент формы зерен.
Для зерен с острыми гранями (например, дробленый кварцевый песок) аф = 1,5÷1,7.
В общем виде потери напора в слое загрузки
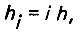 (4.33)
(4.33)где i - гидравлический уклон; h - толщина слоя загрузки.
Гидравлический уклон зависит от скорости фильтрования и других факторов
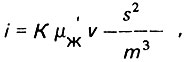 (4.34)
(4.34)где K = 0,0052; μж - динамическая вязкость жидкости; s - площадь удельной поверхности поровых каналов; m - пористость слоя загрузки.
В процессе фильтрования воды слой загрузки может заиляться, а гидравлическое сопротивление его возрастать
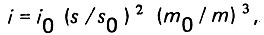 (4.35)
(4.35)где i0, s0 и m0 - соответственно начальный гидравлический уклон, площадь удельной поверхности поровых каналов и пористость чистого слоя загрузки.
По опытным данным Д. М. Минца и других, в процессе заиления площадь удельной поверхности слоя загрузки изменяется в ограниченных пределах. Следовательно, в первом приближении отношение
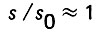 (4.36)
(4.36)и
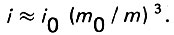 (4.37)
(4.37)Величина
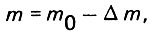 (4.38)
(4.38)
где 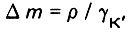
здесь р - плотность насыщения; γk - массовая концентрация взвешенных веществ в единице объема загрузки.
Подставляя значения m и Δm выражении (4.37), найдем
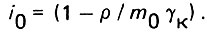 (4.39)
(4.39)Для однородного слоя загрузки коэффициент гидравлического сопротивления
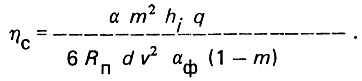 (4.40)
(4.40)Величина
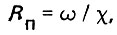 (4.41)
(4.41)где ω - площадь живого сечения потока; X - смоченный периметр зерен загрузки в рассматриваемом сечении.
Средняя скорость фильтрования воды
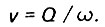 (4.42)
(4.42)Критерий Рейнольдса
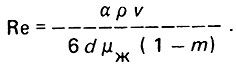 (4.43)
(4.43)Для неоднородного слоя загрузки следует принимать эквивалентный диаметр зерен
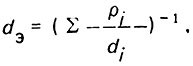 (4.44)
(4.44)При взрыхлении слоя загрузки в восходящем потоке степень расширения его
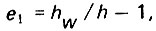 (4.45)
(4.45)где h - начальная высота слоя загрузки до ее расширения; hw - высота расширенного слоя загрузки при интенсивности взрыхления w.
Интенсивность взрыхления (промывки) слоя загрузки зависит от степени его расширения и других параметров
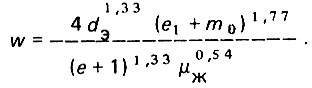 (4.46)
(4.46)Предельное значение интенсивности взрыхления слоя загрузки может быть определено при e1→0, т.е. когда зерна самой мелкой фракции загрузки (d1) только начинают приходить в движение относительно друг друга, а слой загрузки расширяться:
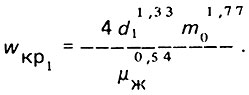 (4.47)
(4.47)Верхний предел интенсивности взрыхления всего слоя загрузки может быть найден следующим образом:
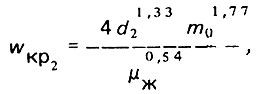 (4.48)
(4.48)где d2 - диаметр зерен самой крупной фракции загрузки.
Стабилизационная обработка дистиллята. Дистиллят относится к слабоминерализованным незабуференным водным растворам. Вследствие этого он обладает свойствами растворителя, а присутствующий в нем диоксид углерода является агрессивным к углеродистым сталям. При этом происходит интенсивное растворение защитной пленки -металла, вследствие чего облегчается доступ к нему кислорода и ускоряется процесс коррозии на анодных участках. Поскольку этот процесс протекает интенсивно на всей поверхности контакта дистиллята с металлом, то происходит ухудшение качества воды и прежде всего загрязнение ее продуктами коррозии (в основном железом).
По данным натурных наблюдений (табл. 4.1) при транспортировании промышленного дистиллята по стальному трубопроводу диаметром 350 мм протяженностью 8 км происходит изменение качества воды по ряду показателей вследствие коррозионного воздействия ее на внутреннюю поверхность стенки трубопровода.

Таблица 4.1
В составе защитной пленки металла присутствует гидрозакись железа, которая взаимодействует с диоксидом углерода, образуя хорошо растворимое вещество гидрокарбонат железа. Образование гидрозакиси железа происходит под действием растворенного в воде кислорода по уравнению
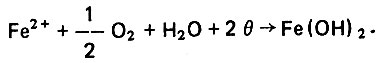 (4.49)
(4.49)Реакция гидрозакиси железа с диоксидом углерода протекает по уравнению
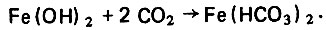 (4.50)
(4.50)При наличии в воде растворенного кислорода гидрокарбонат железа может окисляться с образованием гидроокиси железа и восстановлением диоксида углерода по уравнению
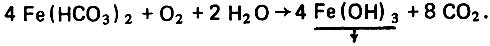 (4.51)
(4.51)Гидроокись железа растворима в воде в меньшей степени и выделяется в твердую дисперсную фазу. Дистиллят становится менее прозрачным и приобретает коричневую окраску. Освободившийся диоксид углерода агрессивен и снова вступает в процесс растворения защитной пленки металла.
Таким образом, происходит достаточно интенсивный цикличный процесс образования и разрушения защитной пленки на смоченной поверхности металла с активным участием кислорода и диоксида углерода. В результате дистиллят загрязняется железом и сокращается срок службы дистиллятопровода, особенно в случае неравномерной коррозии металла с образованием язв и питтингов на внутренней поверхности стенки трубопровода.
Для того чтобы приостановить процесс разрушения защитной окисной пленки на смоченной поверхности стенки стальных дистиллятопроводов, необходимо стабилизировать систему дистиллят-металл и прежде всего связать агрессивную углекислоту. Это можно сделать путем дозировки раствора щелочи (извести, соды). Реакция протекает по уравнениям:
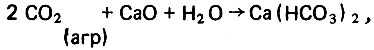 (4.52)
(4.52)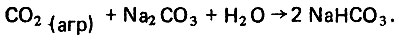 (4.53)
(4.53)В первом случае в воде образуется гидрокарбонат кальция, а во втором - гидрокарбонат натрия, которые способны диссоциировать в водной среде:
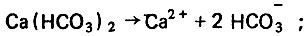 (4.54)
(4.54)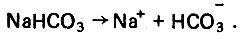 (4.55)
(4.55)При наличии в дистилляте гидрокарбонат-иона повышаются щелочность и рН водной среды. Поскольку содержание в дистилляте агрессивной углекислоты зависит не только от качества морской воды, но и от режима работы термических опреснителей, то дозировка щелочи должна осуществляться очень точно. Вручную это сделать невозможно, а автоматические системы дозирования (АСД) серийно не выпускаются. Индивидуальное изготовление такой системы с соответствующими дозирующими устройствами и контрольными измерительными приборами возможно при наличии квалифицированных специалистов и материально-технической базы Однако из-за сложности и трудоемкости создание надежной АСД обходится дорого и возможно не на каждом объекте. Эти обстоятельства ограничивают применение реагентной стабилизации дистиллята на отечественных опреснительных установках.
Наиболее простым и экономичным способом стабилизации промышленного дистиллята является фильтрационный с применением местных доступных кальций-карбонатных зернистых материалов (мраморной крошки, дробленого известняка и природного зернистого ракушечника). В процессе фильтрования дистиллята через слой кальций-карбонатной загрузки происходит взаимодействие в воде агрессивной углекислоты с зернами карбоната кальция с образованием гидрокарбоната кальция по уравнению
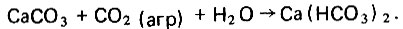 (4.56)
(4.56)Гидрокарбонат кальция находится в растворенном состоянии и диссоциирует в водной среде по уравнению (4.54). Дистиллят как сильный растворитель способен непосредственно воздействовать на карбонат кальция, особенно в динамических условиях (фильтрования). Вследствие этого рН стабильного дистиллята оказывается выше 8,3-8,5, достигая значений 9,0-9,2. Интенсивность растворения карбоната кальция в дистилляте во время фильтрования является важным параметром процесса стабилизации. Этот процесс относится к категории гетерогенных реакций, скорость которых зависит как от химических, так и физических факторов. В данном случае существенное значение имеет адсорбционная стадия процесса, которая характеризуется интенсивностью диффузии СО2 в зону реакции на поверхности зерен СаСО3, а также интенсивностью обратной диффузии продуктов реакции. Поэтому скорость гетерогенных реакций зависит не только от площади удельной поверхности раздела фаз, но и от гидродинамических условий жидкой фазы, контактирующей с поверхностью твердой фазы.
Скорость гетерогенного химического процесса прямо пропорциональна площади активной поверхности реагируемых веществ
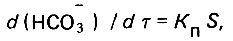 (4.57)
(4.57)где Кn - константа скорости реакции на активной поверхности зерен карбоната кальция в водных растворах; S - площадь активной поверхности зерен карбоната кальция.
Таким образом, чем больше площадь активной поверхности зерен в фильтрующем слое загрузки, тем быстрее будет растворяться карбонат кальция, взаимодействуя с агрессивной углекислотой. Активной поверхностью является поверхность поровых каналов в слое зернистой загрузки. Некоторая часть поверхности зерен, главным образом в местах их соприкосновения является неактивной потому, что в этих местах струйки воды не протекают и агрессивная углекислота слабо диффундирует к поверхности зерен карбоната кальция. То же происходит с обратным процессом, т. е. диффузией кальций-иона и гидрокарбонат-иона в область струйного течения воды.
В динамических условиях контакта, а именно при движении струек воды в поровых каналах слоя загрузки, существенное влияние оказывает турбулентная диффузия. Вследствие зернистой структуры слоя загрузки струйки вынуждены обтекать на своем пути многочисленные зерна различной величины и формы. При этом струйки то соединяются, то разъединяются. В таких условиях движения струй в слое загрузки турбулентность потока в целом значительно повышается. Это обстоятельство, несомненно, способствует ускорению процесса химического взаимодействия карбоната кальция с агрессивной углекислотой, а следовательно, и процесса стабилизации дистиллята. При более высокой начальной концентрации агрессивной углекислоты скорость процесса также возрастает.
В общем виде продолжительность стабилизации дистиллята зависит от начальной концентрации агрессивной углекислоты и эквивалентного диаметра зерен фильтрующего слоя, характеризующего гранулометрический состав загрузки:
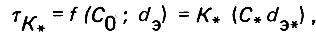 (4.58)
(4.58)
где 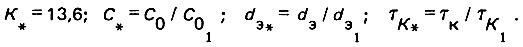
Здесь |CO1| = |dЭ1| = |тК1| = 1, т. е. базовые значения указанных параметров численно равны между собой и могут быть приняты равными единице.
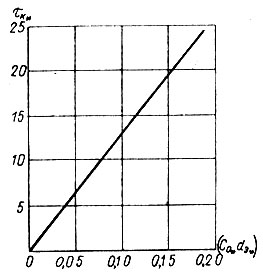
Рис. 4.1. Зависимость (тК* = f (CO**dЭ*)) при полном взаимодействии агрессивного диоксида углерода с мраморной крошкой в стабилизационных фильтрах
Функциональное выражение (4.58) получено в результате обобщения опытных данных по фильтрационной стабилизации дистиллята (рис. 4.1). Параметр К* равен тангенсу угла наклона прямой в безразмерных координатах.
Представление о закономерности процесса стабилизации дистиллята при фильтровании его через неоднородный слой зерен карбоната кальция дает рис. 4.2. На нем семейство кривых тК' = f (CО) показано при различных значениях dэ, сходящихся в начале координатной сетки. Параметры процесса стабилизации имеют единицы измерения: CO' мг*экв СO2 (агр) /л; d'э мм; тK' мин.
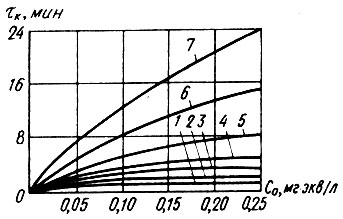
Рис. 4.2. Зависимость тК = f (CO) при полном взаимодействии агрессивного диоксида углерода с мраморной крошкой в динамических условиях 1; 2; 3; 4; 5; 6 и 7 - при dэ равном соответственно 0,05; 0,10; 0,15; 0,20; 0,30; 0,50 и 0,75 мм
В данном случае параметр гк характеризует время полного связывания в дистилляте агрессивной углекислоты. Так как равновесная скорость фильтрования обратно пропорциональна времени контакта тк, то зависимость vp = f (CO) при различных значениях dэ будет иметь вид семейства вогнутых кривых, асимптотически сходящихся в бесконечности на оси абсцисс. Вогнутость кривых свидетельствует о замедлении процесса завершения стабилизации с увеличением начальной концентрации агрессивной углекислоты, что обусловлено увеличением солесодержания дистиллята и буферности карбонатной системы в целом.
Природные известняки могут содержать примеси и в том числе окись магния, которая также реагирует с агрессивной углекислотой, образуя хорошо растворимый в воде гидрокарбонат магния. Образование гидрокарбоната магния в процессе фильтрационной стабилизации дистиллята происходит следующим образом:
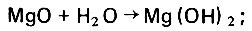 (4.59)
(4.59)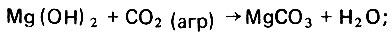 (4.60)
(4.60)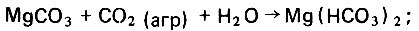 (4.61)
(4.61)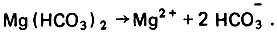 (4.62)
(4.62)В результате в фильтрате содержатся магний-ион и гидрокарбонат-ион. В связи с тем, что присутствие магний-иона в питьевой опресненной воде весьма ограничено содержание в известняке окиси магния лимитируется. Кроме того, при высокой концентрации окись магния непосредственно реагирует с агрессивной углекислотой, минуя стадию гидратации [Мg(ОН)2], образуя карбонат магния, который растворяется в воде. Вследствие этого в фильтрате возрастает карбонатно-магниевая жесткость, что также нежелательно:
 (4.63)
(4.63)Присутствие в дистилляте продуктов коррозии и прежде всего железа может ухудшить процесс его стабилизации вследствие обволакивания зерен двойным соединением Fe(OH)2*СаСO3. Этот неблагоприятный процесс может инициироваться присутствием окиси магния и растворенного кислорода.
Адсорбционную очистку дистиллята, содержащего органические соединения, осуществляют путем фильтрования его через слой зернистого адсорбента. В качестве адсорбента используют гранулированный активный уголь марки БАУ или АГ-3. Последний является менее дефицитным и более доступным.
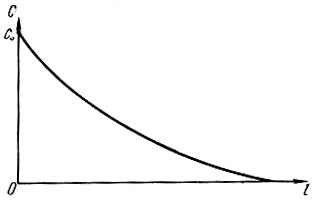
Рис. 4.3. Изменение концентрации адсорбата вдоль пути движения жидкости в рабочем слое адсорбента
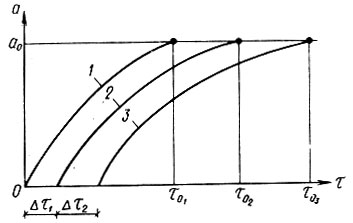
Рис. 4.4. Изменение концентрации адсорбата в зернах элементарного слоя адсорбента 1; 2 и 3 - соответственно для поверхностного и последующих ЭСА
По М. М. Дубинину, поры в активном угле подразделяются на три категории: макропоры, переходные или мезопоры и микропоры. Макропоры с эффективным радиусом от 0,03 до 2,0 мкм играют роль транспортных артерий, по которым органические вещества поступают от поверхности гранулы к мезо- и микропорам. В процессе адсорбции микропоры играют определяющую роль. В микропорах проявляется эффект повышения адсорбционного потенциала благодаря наложению силовых полей, возникающих на стенках поровых каналов. В процессе фильтрования жидкости, содержащей растворенное органическое вещество, происходит массоперенос его из жидкой фазы в твердую. Благодаря этому концентрация вещества (адсорбата) в жидкости вдоль пути движения ее в порах слоя адсорбента постепенно снижается от СО до нуля, а содержание его в гранулах адсорбента во времени возрастает от нуля до равновесной величины а0. Указанные закономерности показаны на рис. 4.3 и 4.4. При постоянной скорости фильтрования жидкости (v = const) кривые с = f(e) и с = f(т) близки по своему очертанию, так как t = vr. Условия адсорбции в каждом последовательно расположенном элементарном слое адсорбента (ЭСА) неодинаковы, так как концентрация адсорбата в жидкой фазе на входе непрерывно убывает, а прирост адсорбента в твердой фазе замедляется. Поэтому при Δт1 = Δт2|т02 - т01|<|n03 - т02| и т. д., что вполне закономерно. Величина а достигает равновесной величины а0 в каждом ЭСА последовательно (рис. 4.5), Кривые зависимости а = f(x) имеют характерную границу раздела при т = т0. Область слева при т#60;т0 характерна тем, что адсорбат полностью задерживается в рабочей зоне фильтрующего слоя адсорбента. В области справа при т>т0 будет проскок адсорбата в защитную зону и из нее в фильтрат, На рис, 4.6 показана зависимость времени работы слоя сорбента от его толщины до момента проскока вещества (адсорбата) в фильтрат, Графическая интерпретация позволяет определить значение т0, равное отрезку ординаты ниже нуля. Тангенс угла наклона прямой к оси абсцисс равен коэффициенту защитного действия tg φ = К, Параметры l0 и lм означают соответственно длину рабочего слоя и длину так называемого "мертвого" слоя адсорбента. Линейная зависимость tпр = f(l) соблюдается при l>l0, а при l<l0 существует переходная область, в которой происходит формирование фронта адсорбции. Далее фронт адсорбции перемещается к выходной границе адсорбционного слоя и наступает момент проскока вещества в фильтрат.
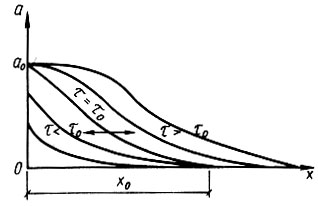
Рис. 4.5. Зависимость э = f (x) при различных значениях Т. х0 - высота работающего слоя адсорбента; Т0 - время формирования работающего слоя адсорбента
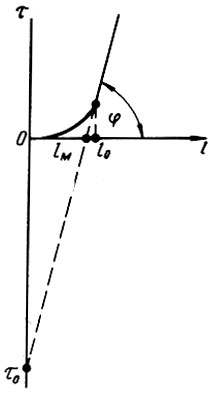
Рис. 4.6. Зависимость времени работы слоя сорбента до момента проскока вещества в фильтрат от его толщины
На рис. 4.7 показана зависимость остаточной концентрации вещества от времени фильтрования. Кривая проскока С = f (r) имеет характерные точки 1, 2, 3 и 4. Точка 1 соответствует началу проскока, а точка 2 предельно допустимому значению проскока. Точки 3 и 4 характеризуют соответственно равновесную и исходную концентрации вещества. Движущая сила массопереноса характеризуется разностью концентраций вещества в жидкости (Cj - Cj+l) соответственно на входе и выходе из соответствующего элементарного слоя адсорбента. Значение ее вдоль пути фильтруемой жидкости постепенно уменьшается вследствие снижения входной концентрации вещества Сj, а также вследствие роста концентрации вещества в пограничном слое гранул адсорбента. В силу этих обстоятельств удельная адсорбционная емкость адсорбента а0 не достигает предельной возможной адсорбционной емкости а∞.
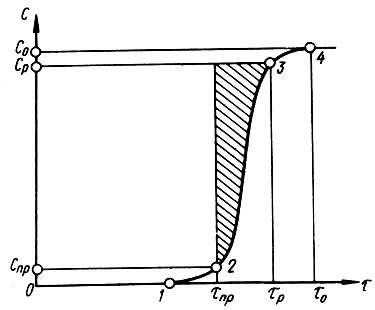
Рис. 4.7. Зависимость остаточной концентрации вещества от времени фильтрования (кривая проскока)
Максимальная равновесная адсорбционная емкость слоя адсорбенту составит
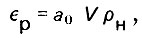 (4.64)
(4.64)где V - объем слоя адсорбента; ρн - насыпная плотность адсорбента.
Объем слоя адсорбента равен
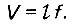 (4.65)
(4.65)где t - длина (толщина) слоя адсорбента; f - площадь фильтра.
При работе фильтра до момента проскока растворенного вещества вместе с фильтратом в нижней зоне слоя адсорбента удельная адсорбционная емкость его используется на величину ас<а0.
Полагая общую длину слоя адсорбента I, равной сумме длин двух зон - верхней lB и нижней lH, определим действительную адсорбционную емкость слоя адсорбента в фильтре
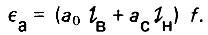 (4.66)
(4.66)Адсорбционная нагрузка на фильтр может быть определена следующим образом:
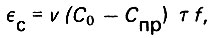 (4.67)
(4.67)где v - средняя скорость фильтрования воды; Т - продолжительность фильтро-цикла.
Исходя из условия материального баланса, можно записать
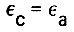 (4.68)
(4.68)или
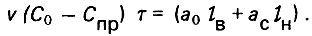 (4.69)
(4.69)Левая часть равенства означает количество вещества, изъятого из жидкой фазы, а правая - такое же количество вещества, адсорбированного на твердой фазе. Из выражения (4.69) следует, что продолжительность работы адсорбционного фильтра
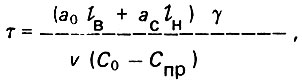 (4.70)
(4.70)где lBи lH нижней зон фильтрующего слоя адсорбента, С0 и Спр - средние исходная и проскоковая концентрации вещества в жидкой фазе.
По Н. А. Шилову*, уравнение динамики адсорбции растворенного вещества из фильтруемой жидкости до момента его проскока можно представить в следующем виде:
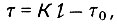 (4.71)
(4.71)где т - продолжительность работы слоя адсорбента; К - коэффициент защитного действия; L - длина слоя (толщина) в насыпном гранулированном слое; т0 - потеря времени защитного действия.
* (Шилов Н. А., Лепинь Л. К., Вознесенский С. А. К вопросу об абсорбции постороннего газа из тока воздуха // Журнал русского физико-химического общества, Сер. "Химия", т. 61, вып. 7.- 1969.)
При работе слоя адсорбента с граничным проскоком
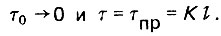 (4.72)
(4.72)При большей скорости процесса адсорбции коэффициент защитного действия
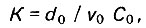 (4.73)
(4.73)где ν0 - объемная скорость фильтрования.
В зоне градиента удельная адсорбция а изменяется от а0 до нуля. Поэтому количество вещества, адсорбированного на этом участке слоя, будет меньше максимального содержания его в отработавшем слое адсорбента. Недоиспользованная адсорбционная емкость упомянутого слоя адсорбента составляет
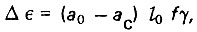 (4.74)
(4.74)где ас - удельная адсорбционная емкость недоиспользованного слоя.
Приравняем величину Δ ∈ к адсорбционной емкости слоя свежего полностью неиспользованного ("мертвого") адсорбента
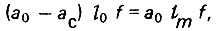 (4.75)
(4.75)откуда
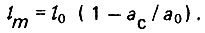 (4.76)
(4.76)Основное уравнение динамики адсорбции вещества из потока слоем адсорбента можно представить в виде
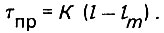 (4.77)
(4.77)Тогда
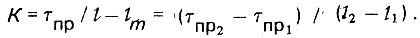 (4.78)
(4.78)Следовательно,
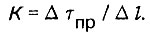 (4.79)
(4.79)В данном случае
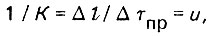 (4.80)
(4.80)т. е. скорости продвижения фронта адсорбции в слое адсорбента. Параметр IQ может быть определен из следующего выражения:
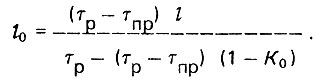 (4.81)
(4.81)При изотерме, описываемой уравнением Лэнгмюра, длина работающего слоя адсорбента может быть определена по формуле, предложенной Я. М. Биксоном:
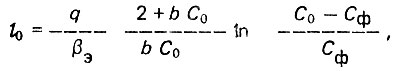 (4.82)
(4.82)где q - расход жидкости; βЭ - эффективный коэффициент массопереноса; b - константа адсорбционного равновесия в уравнении Лэнгмюра.
Величина βЭ связана с соответствующими коэффициентами внешнего βВН и внутреннего βВТ массопереноса, а также с коэффициентом продольной диффузии DПР следующим функциональным выражением;
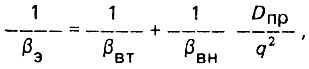 (4.83)
(4.83)откуда
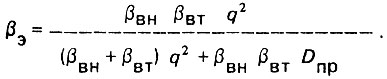 (4.84)
(4.84)Параметр DПР учитывает перенос вещества с фильтратом и является гидродинамической характеристикой потока. Он оказывает влияние на размыв границы фронта адсорбции, а следовательно, на эффект работы слоя адсорбента. Процесс адсорбции протекает в две характерные стадии: первая - формирование фронта адсорбции (при 0<τ>τ0) и вторая - параллельный перенос этого фронта в направлении движения раствора в слое адсорбента (при τ>τ0). В момент τ = τ0 концентрация адсорбата в сечении слоя адсорбента достигает равновесной величины a0.
Процесс адсорбции из дистиллята органических микрозагрязнений можно описать следующей системой дифференциальных уравнений в частных производных:
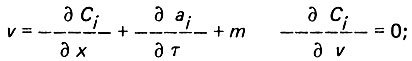 (4.85)
(4.85)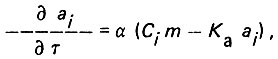 (4.86)
(4.86)где Cj и aj - концентрация адсорбата соответственно в жидкой и твердой фазах; m - пористость слоя адсорбента; v - скорость фильтрования жидкости; Я - коэффициент массопереноса Кэ = 1/Г (здесь Г - константа Генри).
По опытным данным, Г = 104 - 106, что позволяет процесс адсорбции рассматривать как линейную
зависимость и упростить расчетные выражения. Начальные и граничные условия процесса адсорбции принимают для стадий:
первой:
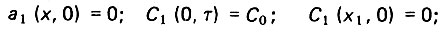 (4.87)
(4.87)второй:
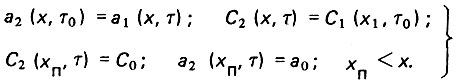 (4.88)
(4.88)При условиях
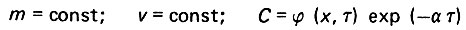 (4.89)
(4.89)дифференциальное уравнение (4.85) имеет вид
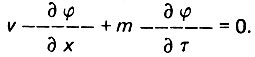 (4.90)
(4.90)Интеграл этого уравнения
 (4.91)
(4.91)В общем виде концентрация вещества в жидкой и твердой средах может быть определена для стадий процесса
первой (τ≤τ0):
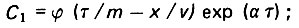 (4.92)
(4.92)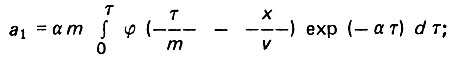 (4.93)
(4.93)второй (τ>τ0) :
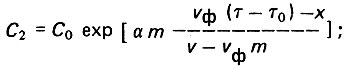 (4.94)
(4.94)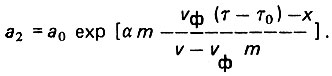 (4.95)
(4.95)При x = l
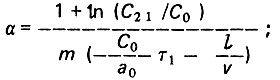 (4.96)
(4.96)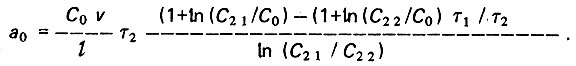 (4.97)
(4.97)При C2 = Cпр
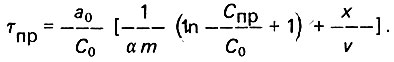 (4.98)
(4.98)При СПР = С0, что соответствует полной заработке слоя адсорбента,
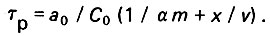 (4.99)
(4.99)Теоретический анализ процесса адсорбции позволил получить основные зависимости для технологического расчета адсорберов применительно к условиям глубокой очистки термически опресненной воды (дистиллята).
В процессе фильтрования промышленного дистиллята активный уголь загрязняется органическими веществами, продуктами коррозии металла (главным образом, железа) и механическими примесями. В соответствии с характером загрязнений осуществляют тот или иной способ регенерации адсорбента. Механические примеси обычно удаляют из слоя адсорбента путем взрыхления и отмывки обратным током очищенной воды (снизу вверх). Для очистки слоя адсорбента от железа и других продуктов коррозии применяют кислотную обработку. Наилучший эффект достигается при обработке слоя адсорбента раствором соляной кислоты и времени контакта в динамических условиях. При этом гидратированная окись железа реагирует с хлористым водородом с образованием хорошо растворимого в воде хлорного железа по уравнению
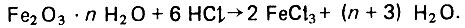 (4.100)
(4.100)Хлорное железо вместе с отработавшим раствором кислоты удаляется при отмывке слоя адсорбента. На рис. 4.8 показана зависимость эффекта регенерации БАУ от способа обработки и времени контакта с 5%-ным раствором соляной кислоты (по данным Г. А. Ивлевой). Предварительное взрыхление водой слоя адсорбента позволяет примерно на 13% повысить эффект регенерации. Оптимальная продолжительность контакта адсорбента с кислотой равна 90 мин. Адсорбент был частично загрязнен органическими веществами, которые кислотной обработкой не удаляются. Этим объясняется неполное восстановление адсорбционной способности активного угля.
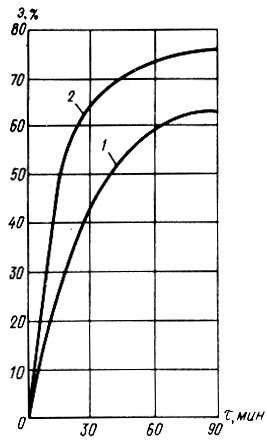
Рис. 4.8. Зависимость эффекта регенерации от времени контакта с продуктами коррозии железа при кислотной обработке БАУ. 1 - обработка БАУ 5%-ным раствором соляной кислоты; 2 - взрыхление водой + кислотная обработка (5%-ным HCl)
Одновременно с загрязнением адсорбента механическими примесями и продуктами коррозии металла происходит биологическое обрастание зерен его в результате жизнедеятельности водных микроорганизмов, особенно при сравнительно продолжительном непрерывном фильтровании дистиллята в сорбционных аппаратах (более 10-15 сут). Высокая температура дистиллята (30-35°С) и пористая поверхность зерен активного угля благоприятствует указанному биологическому процессу. При этом по мере развития этого процесса заметно возрастает гидравлическое сопротивление слоя загрузки и, кроме того, наблюдается ухудшение качества фильтрата по бактериологическим показателям.
В целях подавления биологических процессов в слое активного угля периодически не реже 1 раза в 7-10 сут производят обеззараживание его активным хлором. Режим обработки загрузки следующий: взрыхление загрузки обратным током воды (3-5 мин), заполнение слоя загрузки хлорной водой (5-10 мг Сl2/л) с последующей выдержкой в течение 60-90 мин, отмывка загрузки обратным током очищенной воды.
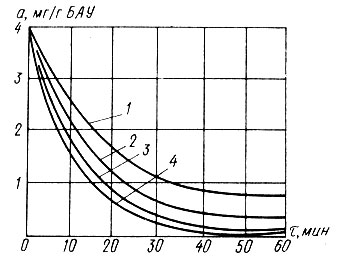
Рис. 4.9. Кинетические кривые термической регенерации БАУ. 1; 2; 3 и 4 - при температуре, равной соответственно 200; 300; 400 и 500 ºС
Восстановление адсорбционной способности активного угля, загрязненного органическими веществами, осуществляют его термической обработкой. В качестве теплоносителя используют перегретый пар или паровую смесь, содержащую продукты сгорания топлива. Известны два режима термической регенерации адсорбента: высокотемпературный в специальных печах и низкотемпературный непосредственно в сорбционных аппаратах (без перегрузки). При первом режиме термической регенерации температуру рабочей среды поддерживают на уровне 700-1000°С, а при втором - на уровне 300-500°С, Г. А. Ивлевой получены кинетические кривые термической регенерации БАУ при температурах среды 200; 300; 400 и 500ОС (рис. 4.9). Полное восстановление адсорбционной емкости БАУ по фенолу получено Г. А. Ивлевой при температуре 500°С в течение 60 мин (рис. 4.10).
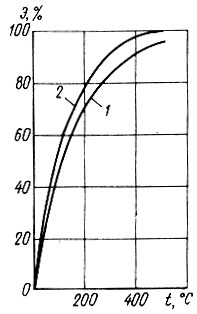
Рис. 4.10.Зависимость сорбционной емкости по фенолу от температуры термической регенерации активного угля БАУ. 1 и 2 - при термической обработке угля в течение соответственно 30 и 60 мин
Для минимального снижения потерь угля в процессе его термической обработки необходимо максимально снизить содержание кислорода в теплоносителе. При высокотемпературном режиме обработки адсорбента достигается практически полное разложение органических веществ до "минеральных составляющих, но удельные энергозатраты на весь процесе и потери угля значительны. При низкотемпературном режиме обработки адсорбента деструкции подвергаются только менее стойкие органические вещества, а более стойкие органические вещества десорбируются и конденсируются вместе с паром. Поэтому конденсат является более загрязненным. В этом случае при термической регенерации превалирует процесс отгонки адсорбированных веществ, а потери угля на обгар значительно меньше. Весь режим низкотемпературной обработки активного угля энергетически более рационален и экономичен. Загрязненный конденсат, содержащий органические вещества, подвергается дожиганию в камере перегрева пара. Это позволяет снизить опасность загрязнения окружающей среды. Отработавшие Продукты сгорания топлива подвергаются доочистке от механических примесей - в циклонах, а от растворенных веществ - мокрым способом в скрубберах, оборудованных системой дождевания.
При наличии в теплоносителе кислорода происходит деструктивное окисление органического вещества с выделением тепловой энергии по уравнению
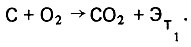 (4.101)
(4.101)В продуктах сгорания органического топлива содержание кислорода допускается не более 2-5%.
При температуре 500°С водяной пар действует на органические вещества как сильный окислитель с затратой тепловой энергии
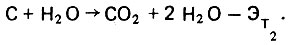 (4.102)
(4.102)При более высокой температуре (> 500 º C) реакция окисления паром органических веществ протекает интенсивней с большей затратой тепловой энергии
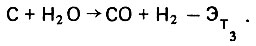 (4.103)
(4.103)Сравнительная характеристика газов-теплоносителей приведена в табл. 4.2.

Таблица 4.2
Обогащение дистиллята гидрокарбонатом кальция. Содержащейся в дистилляте агрессивной углекислоты недостаточно для обогащения его гидрокарбонатом кальция. Поэтому в дистиллят дополнительно дозируют водный раствор баллонной углекислоты или углекислоты сдувочных газов термических испарителей морской воды.
В процессе фильтрования дистиллята через кальций-карбонатную загрузку происходит растворение твердой фазы карбоната кальция с переходом в раствор карбонат- и кальций-ионов
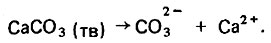 (4.104)
(4.104)Определенное количество из поступивших в раствор карбонатных ионов соединяется с имеющимися в растворе ионами водорода и образуются гидрокарбонатные ионы
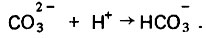 (4.105)
(4.105)Связывание ионов водорода в гидрокарбонаты сдвигает вправо реакцию диссоциации воды и тем самым увеличивает концентрацию в растворе гидроксильных ионов с соответствующим повышением рН, что описывается схемой
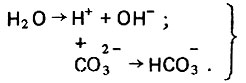 (4.106)
(4.106)Содержащаяся в растворе углекислота значительно интенсифицирует процесс растворения карбоната кальция, так как выводит гидроксильные ионы из зоны реакции, вступая с последними во взаимодействие следующим образом:
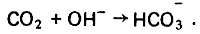 (4.107)
(4.107)Вывод гидроксильных ионов из зоны реакции за счет связывания углекислоты в конечном итоге сдвигает вправо процесс по уравнению (4.104). Таким образом, количество карбоната кальция, способного раствориться в дистилляте, находится в прямой зависимости от содержания в последнем углекислоты. При этом обогащение дистиллята кальций-ионом происходит в результате реакции по уравнению (4.104), а содержание гидрокарбонат-иона в обогащенном дистилляте определяется суммарным количеством его по уравнениям (4.105) - (4.107). Оптимальный режим обогащения дистиллята кальций- и гидрокарбонат-ионами устанавливают пробной обработкой, а именно путем дозировки в дистиллят водного раствора углекислоты и фильтрования его через модель фильтра обогащения. Высоту слоя загрузки и ее гранулометрический состав рекомендуется принимать близкими к натурным условиям. Это позволяет получить более надежные опытные данные без моделирования процесса.
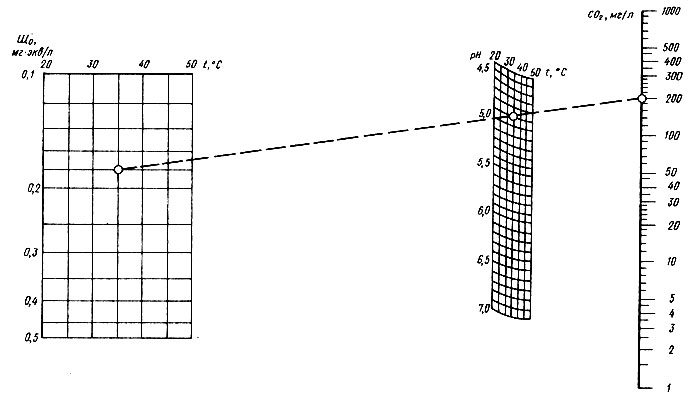
Рис. 4.11. Номограмма № 1 для определения содержания свободной углекислоты (при соответствующем давлении) в дистилляте опреснительных установок
При невозможности провести пробную обработку дистиллята в режиме обогащения его гидрокарбонатом кальция можно воспользоваться номограммами № 1 и 2, разработанными Г. С. Хованским и А. А. Говертом на основе решения на ЭВМ системы уравнений материального баланса и закона действия масс, характеризующей количественные соотношения компонентов карбонатно-кальциевого равновесия в процессе фильтрационного обогащения дистиллята. Номограмма № 1, (рис. 4.11) позволяет определить содержание свободной углекислоты в дистилляте в зависимости от рН, общей щелочности и температуры.
Пример 4.1. Исходные данные: ЩО = 0,18 мг*экв/л, t = 35ºC, pH = 4,9. По номограмме находим: СО2 =200 мг/л.
Номограмма № 2 (рис. 4.12) позволяет рассчитать количество кальций-иона в обогащенном дистилляте методом фильтрования его через кальций-карбонатную загрузку. Исходные параметры дистиллята те же, что и на номограмме № 1.
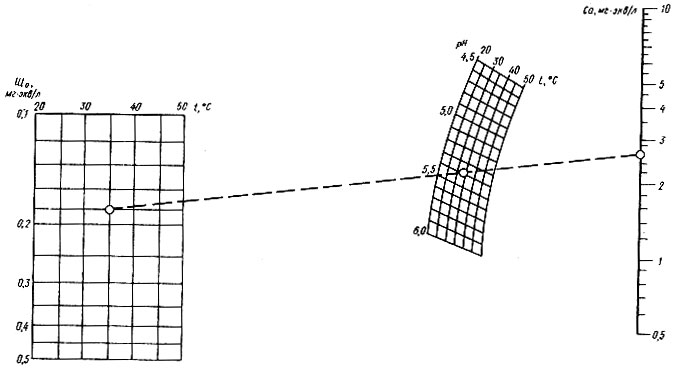
Рис. 4.12. Номограмма № 2 для определения расчетного количества кальция в обогащенном диоксидом углерода и профильтрованном через дробленый карбонат кальция дистилляте опреснительных установок
Пример 4.2. Исходные данные ЩO = 0,18 мг*экв/л, Г = 35ºС, рН = 5,4. По номограмме находим: ССА = 2,6 мг*экв/л.
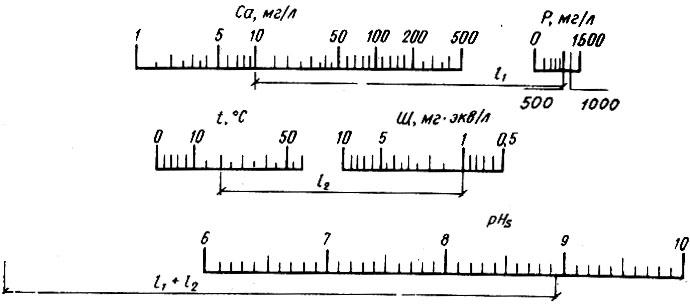
Рис. 4.13. Номограмма № 3 для определения pHS насыщения воды карбонатом кальция
Фактическое значение рН насыщения воды гидрокарбонатом кальция определяют в результате карбонатных испытании по известной методике на реальной пробе воды, с применением порошкообразного карбоната кальция. При отсутствии такой возможности расчетное значение рН можно определить по номограмме № 3 (рис. 4.13), предложенной А. А. Говертом и Г. С. Хованским, номограмма построена по формуле
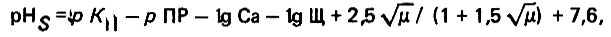
где K∩ и рПР - отрицательные логарифмы соответственно второй ступени диссоциации угольной кислоты и произведения растворимости карбоната кальция; ионная сила = 0,000022Р.
Пример 4.3. Исходные данные: содержание кальция Са = 10 мг/л, содержание Р = 500 мг/л; t = 20°С, Щ = 1 мг*экв/л.
По номограмме находим: рН = 8,92.
В процессе фильтрационного обогащения дистиллята загрузка расходуется по карбонату кальция значительно интенсивнее, чем при стабилизации дистиллята. Удельный расход карбоната кальция, г/(м2*ч), можно определить по формуле
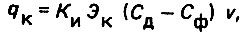 (4.108)
(4.108)где КИ - коэффициент, учитывающий присутствие инертных примесей (КИ = 1,1); ЭК - химический эквивалент (ЭК = 2,274); Сд и Сф - концентрации двуокиси углерода до и после фильтрования дистиллята, г/м3; v - приведенная скорость фильтрования воды, м/ч.
Общий расход загрузки, кг, будет
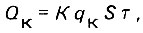 (4.109)
(4.109)где К = 0,001; S - площадь рабочих фильтров, м2; Т - продолжительность работы фильтров между догрузками, ч.
Догрузку фильтров обогащения производят ежемесячно или 1-2 раза в квартал. Операция по догрузке фильтров может быть осуществлена без остановки их. Фильтрование дистиллята с агрессивной углекислотой лучше осуществлять снизу вверх с подачей его через дренажную систему. В этом случае потери углекислоты в атмосферу значительно меньше и, кроме того, в первую очередь расходуются более дешевые крупные фракции кальций-карбонатной загрузки. Гидравлическое сопротивление слоя загрузки более устойчивое благодаря отсутствию слеживания, что обычно наблюдается при фильтровании дистиллята сверху вниз.
Необходимо иметь в виду, что при фильтровании дистиллята через кальций-карбонатную загрузку в режиме обогащения с предварительно введенной углекислотой возможен проскок последней. Эта кислота может быть связана щелочью на следующем этапе обработки в режиме кондиционирования питьевой опресненной воды.
При смешении дистиллята с минерализованной водой возрастает общее солесодержание питьевой воды до заданного уровня, определенного технологическими и санитарно-гигиеническими требованиями, б процессе смешания присутствующие в воде компоненты ведут себя по-разному. Одни компоненты устойчиво находятся в жидкой фазе, а другие имеют склонность переходить при определенных условиях в твердую или газообразную фазы и вновь возвращаться в жидкую фазу. Первая группа компонентов относится к категории консервативных, а вторая - неконсервативных. В качестве представителей первой группы можно отметить ионы натрия, хлориды и сульфаты, а второй - ионы кальция и магния, карбонат-ион, гидрокарбонат-ион, растворенный кислород, двуокись углерода и др.
Концентрацию консервативного компонента в смеси можно определить по формуле
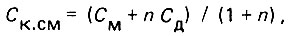 (4.110)
(4.110)где См и Сд - концентрации компонента соответственно в минерализованной воде и дистилляте; n - кратность разбавления, равная отношению долевых расходов дистиллята и минерализованной воды.
Концентрация неконсервативного компонента в процессе смешения изменяется по более сложному закону, обусловленному в той или иной мере побочными фазовыми процессами. В общем виде имеем:
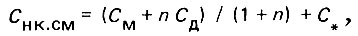 (4.111)
(4.111)где С# - приращение (убыль) концентрации неконсервативного компонента во времени в зависимости от протекающего побочного процесса.
Побочный процесс фазовых превращений неконсервативного компонента протекает в различных условиях с неодинаковой скоростью. Поэтому величина С# может быть представлена некоторой функцией времени различной степени сложности. В простейших случаях для ограниченной области C# = f (τ) удовлетворительно аппроксимируется линейной функцией, а в других случаях - более сложной степенной или показательной функцией.
Величина Сх может изменяться в зависимости от ряда факторов и в том числе от применяемых неконсервативных компонентов. В этом случае зависимость C# = f (х1, х2, ..., хn) описывается замкнутой системой дифференциальных уравнений
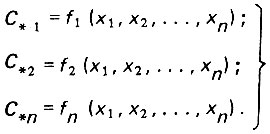 (4.112)
(4.112)При решении указанной системы обычно стремятся получить рациональную функцию, удобную для практического использования. При этом прибегают к некоторым допущениям с последующей оценкой возможной погрешности.
Учитывая сложные условия поведения неконсервативных компонентов, интегральное значение С# для того или иного компонента более надежно определять опытным путем применительно к условиям смешения опресненной и минерализованной воды.
Коррозионная активность воды с повышенным содержанием хлоридов и сульфатов. Смесь дистиллята с минерализованной водой может быть коррозионно активной вследствие содержания в ней хлоридов и сульфатов. Современная теория электрохимической коррозии основана на представлении о том, что самопроизвольное растворение металла в электролитах является результатом протекания двух независимых друг от друга электрохимических реакций - анодной ионизации металла:
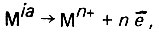 (4.113)
(4.113)и катодного восстановления окислительного компонента коррозионной среды:
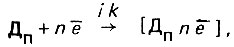 (4.114)
(4.114)где i скорость соответствующих процессов; Дn - деполяризатор.
Для коррозии железа в нейтральной среде эти реакции могут быть записаны в-следующем виде:
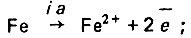 (4.115)
(4.115)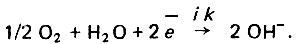 (4.116)
(4.116)Ассимиляция электронов может происходить:
при разрядке ионов металла
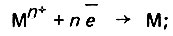 (4.117)
(4.117)при уменьшении валентности катионов металла
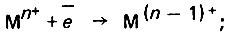 (4.118)
(4.118)при ионизации галогенов
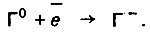 (4.119)
(4.119)Из всех возможных реакций катодной деполяризации в реальных условиях наибольшее распространение имеет реакция с кислородной или смешанной кислородно-водородной деполяризацией.
В отличие от общепринятой теории микропор с обязательным пространственным разделением катодной и анодной реакций современная теория электрохимической коррозии рассматривает корродирующий металл как единый электрод с эквипотенциальным состоянием поверхности. На этом электроде независимо друг от друга сопряженно протекают анодная и катодная реакции. При этом число электронов, выделяющихся в результате анодной реакции, равняется числу электронов, присоединяемых к окислителю-деполяризатору. Скорость электрохимической коррозии определяется общим значением потенциала на границе металл - электролит, составом коррозионной среды и условиями диффузии компонентов или продуктов реакции в растворе.
В коррозионных процессах особая роль принадлежит анионам, которые могут оказывать как ингибирующее, так и стимулирующее действие на коррозионный процесс. Установлено, что хлориды и сульфаты в повышенных концентрациях способствуют развитию коррозии, а анионы НСO3- и РO43-, напротив, тормозят коррозионный процесс.
В связи с этим возникло представление о механизме растворения металла как о процессе комплексообразования. Современные исследования позволяют утверждать, что анионы участвуют в образовании промежуточных комплексов. Эти комплексы могут распадаться и тем самым каталитически ускорять коррозионный процесс. По М. Я. Колотыркину* принципиальная схема участия анионов в электрохимическом процессе коррозии металла состоит из трех стадий:
хемосорбции аниона Az-а:
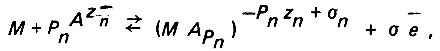 (4.120)
(4.120)
где zn - валентность аниона; 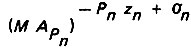 - поверхностный комплекс; σn - доля электронного заряда, затраченного на образование химической связи;
- поверхностный комплекс; σn - доля электронного заряда, затраченного на образование химической связи;
ионизации комплекса:
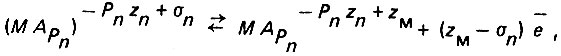 (4.121)
(4.121)где zM - валентность металла;
химического преобразования комплекса, например, его диссоциации, в результате которой ионы регенерируются:
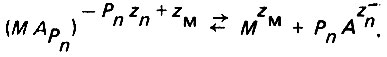 (4.122)
(4.122)* (Колотыркин М. Я., Попов Ю. А., Алексеев Ю. В. О механизме влияния анионов раствора на кинетику растворения металлов, роль взаимодействия // Электрохимия.- 1973, №9.)
Показано также, что растворение железа по каталитическому механизму происходит следующим образом: вначале протекает специфическая адсорбция соответствующей молекулы или иона на металле с образованием поверхностного комплекса, а затем электрохимическая адсорбция, лимитирующая скорость всего процесса. Последняя заключается в переходе указанного комплекса в растворенное состояние. При этом скорость концентрации поверхностного комплекса зависит от его активности, обусловленной природой металла и адсорбирующегося компонента. В этом случае может возникнуть конкурирующая адсорбция различных компонентов раствора. Все эти процессы в той или иной степени обусловливают стимулирующее и ингибирующее действия компонентов на процесс коррозии металла. В нейтральных растворах хлоридоз растворение железа протекает с образованием комплексного иона 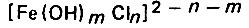 по схеме:
по схеме:
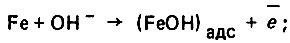 (4.123)
(4.123)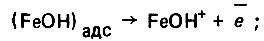 (4.124)
(4.124)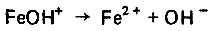 (4.125)
(4.125)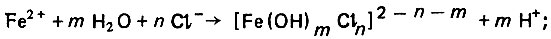 (4.126)
(4.126)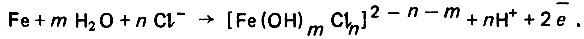 (4.127)
(4.127)Роль этого комплекса состоит в стимулировании процесса перехода атома железа из кристаллической решетки в раствор. Однако этот комплекc нестоек и разлагается с образованием гидратного комплекса железа, а также хлоридов, которые переходят в раствор и вновь участвуют в процессе растворения железа.
В растворах галогенид-ионов коррозия может подавляться с помощью ионов, способных вытеснять их с поверхности металлов. Если расположить такие ионы в порядке возрастания пассивирующего действия, то получится следующий ряд:
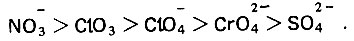 (4.128)
(4.128)В водопроводных сетях на внутренней поверхности стальных труб образуется железисто-карбонатная пленка, которая имеет довольно сложный состав. В нижнем слое пленки расположены продукты окалины (образующейся при изготовлении труб) в виде различных модификаций окислов железа: FeO, Fe2O3, Fe3O4. Слой окалины покрывается гидроокисью и гидрозакисью железа, образующихся в процессе коррозии стенки труб. Двойной слой на поверхности металла служит некоторой защитой металла от коррозионного воздействия среды, так как способствует замедлению диффузии деполяризатора к его поверхности и препятствует выходу ионов металла в раствор. Однако в пленке имеются поры и трещины, через которые все же происходит контакт металла с агрессивной средой. В местах неплотностей возникает коррозия в виде питтингов и язв. Сам факт образования осадка на внутренней поверхности стенки трубы еще ничего не говорит о его защитных свойствах. Различные факторы, в частности, содержание в воде органических веществ, хлоридов, сульфатов и др., могут ухудшать прочность слоя осадка. Важную роль играет также показатель рН среды.
Как правило, образование и отложение карбоната кальция происходит на катодных участках, где скапливается значительное количество, гидроксил-ионов. Гидроксил-ионы в катодных областях способствуют повышению рН воды, что ведет к распаду гидрокарбонат-ионов с образованием карбонат-ионов, которые с присутствующими ионами кальция образуют нерастворимый осадок карбоната кальция на поверхности металла. Отложения, образовавшиеся преимущественно на катодных участках, пассивируют металл и препятствуют доступу кислорода - деполяризатора и тем самым развитию коррозии. Площадь анодных участков оказывается мало защищенной и может возрастать в результате воздействия на защитную пленку хлоридов, сульфатов и других коррозионных агентов.
Для оценки стабильности воды используют различные показатели. Общеизвестным является показатель стабильности, равный отношению щелочности воды к ее щелочности при равновесном карбонатном насыщении.
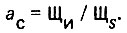 (4.129)
(4.129)При ас = 1 вода является стабильной. При ас>1 вода перенасыщена и способна давать карбонатные отложения, а при ас<1 вода растворяет карбонатные отложения и оказывается коррозионно-активной к углеродистым сталям. Более общим показателем стабильности воды является так называемый индекс насыщения (Ланжелье), равный разности рН исходной воды и ее pHS в состоянии равновесного карбонатного насыщения
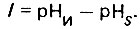 (4.130)
(4.130)При l = 0 вода стабильна. При l>0 вода предрасположена к образованию карбонатных отложений, а при l<0 - к растворению карбонатных отложений и коррозионному воздействию на углеродистые стали. Значение рН равновесного карбонатного насыщения можно определить по номограмме (см. рис. 4.13) в зависимости от влияния четырех факторов: температуры воды, концентрации в ней кальция, щелочности и общего солесо держания.
Необходимо, однако, отметить, что в действительности состояние равновесного карбонатного насыщения водно-химической системы является более сложным. Поэтому более надежным является установление рНS воды путем карбонатных испытаний. Методика карбонатных испытаний заключается в следующем: в колбу с притертой пробкой заливают определенное количество испытуемой воды (0,5 л), после чего в нее вводят чистый то ко дисперсный карбонат кальция (50 г). Затем колбу закрывают и подвергают интенсивному встряхиванию в течение 30 мин и более. В результате контакта в динамических условиях происходит либо растворение карбоната кальция, либо, наоборот, выделение его из жидкой фазы в зависимости от того, в каком состоянии находится водная среда,- в недонасыщенном или перенасыщенном по отношению к кальций-иону и гидрокарбонатам. При этом рН среды изменяется, т. е. возрастает или снижается по отношению к исходному значению. Сдвиг значения рН воды в процессе карбонатных испытаний происходит до определенного уровня, соответствующего достижению кальций-карбонатного равновесия.
Зная щелочность Щи и рН воды до испытаний и определив соответствующие значения ЩS и pHS после испытаний, можно вычислить показатель стабильности ас и l равновесного карбонатного насыщения. Для более точного определения aс и l время контакта воды с дисперсным карбонатом кальция целесообразно увеличить до 3 ч. Обычно карбонатные испытания пробы воды осуществляют при комнатной температуре (20°С). В реальных условиях температура воды, например в оборотном цикле водяного охлаждения, может существенно отличаться от комнатной температуры, особенно при выходе ее из технологического оборудования (35-55°С). В этих случаях карбонатные испытания пробы воды производят на соответствующем температурном уровне с использованием известных приемов термостатирования. Если теплообмен происходит в замкнутом циркуляционном контуре, то желательно отбор пробы воды и ее испытания произвести по закрытой схеме, т. е. без контакта воды с атмосферой, чтобы исключить возможность деформации газового режима водной среды, характерного для замкнутых циркуляционных контуров систем водяного охлаждения различных тепловыделяющих устройств и оборудования.
Наряду с индексом Ланжелье применяют также показатель Ризнера, который определяется из следующего выражения;
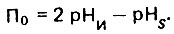 (4.131)
(4.131)В отличие от индекса Ланжелье показатель Ризнера, как правило, имеет положительное значение. При П0 = pHS вода стабильна. При П0>pHS вода способна давать карбонатные отложения, а при П0<рНS - растворять карбонатные отложения и оказывать коррозионное воздействие на углеродистые стали.
Показатели aс, l и П0 не учитывают в полной мере влияние хлоридов и сульфатов, которые могут присутствовать в воде в значительных концентрациях, особенно при искусственном приготовлении питьевой воды из дистиллята с добавкой минерализованной воды (артезианской или морской).
В американском стандарте на питьевую воду рекомендуется следующий показатель:
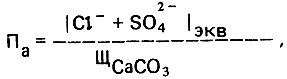 (4.132)
(4.132)
где 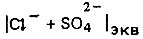 - суммарная концентрация хлоридов и сульфатов, мг*экв/л; ЩCaCO3 - щелочность воды в расчете на содержание карбоната кальция, мг/л.
- суммарная концентрация хлоридов и сульфатов, мг*экв/л; ЩCaCO3 - щелочность воды в расчете на содержание карбоната кальция, мг/л.
Стимулирующее действие хлоридов и сульфатов на коррозионную активность воды подавляется при условии
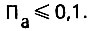 (4.133)
(4.133)Показатель, характеризующий отношение хлоридов к гидрокарбонатам в эквивалентной безразмерной форме,равен
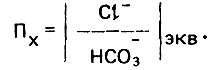 (4.134)
(4.134)При Пх≤0,2 стимулирующее действие хлоридов подавляется. Влияние сульфатов этим показателем, естественно, не учитывается. Необходимо, однако, отметить, что указанные показатели нельзя признать вполне корректными.
Стимулирующее влияние хлоридов и сульфатов на коррозионную активность воды предложено оценивать двумя безразмерными показателями:
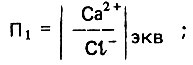 (4.135)
(4.135)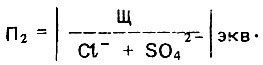 (4.136)
(4.136)Указанные показатели обоснованы специальными экспериментальными исследованиями и натурными наблюдениями при транспортировании питьевой опресненной воды с повышенным содержанием хлоридов и сульфатов. Присутствие в такой воде кальций-иона способствует образованию более прочной защитной пленки на внутренней поверхности стенки стальных трубопроводов. В то же время известно, что хлорид-ион является более подвижным компонентом, способным проникать через защитную пленку. Следовательно, показатель П1 характеризует общее влияние кальций- и хлорид-ионов на защитную пленку на внутренней поверхности стенки стальных трубопроводов.
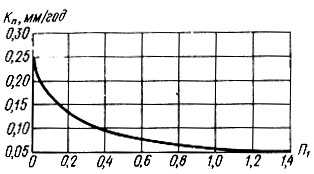
Рис. 4.14 Зависимость KП = f1 (П1) для образцов из Ст3 в водном растворе, содержащем кальций и хлориды (по И. С. Родиной)
На рис. 4.14 показана закономерность снижения коэффициента коррозионной проницаемости от показателя Кп при контакте стальных образцов (Ст3) с водным раствором, содержащим кальций и хлориды. Судя по характеру кривой, зависимость KП = f1 (П1), полученная экспериментально, прослеживается достаточно четко. Показатель П2 отличается от показателя Па тем, что отношение щелочности к суммарной концентрации хлоридов и сульфатов представлено в более корректной эквивалентной безразмерной форме. При повышении П2 коррозионное воздействие воды на образцы из углеродистой стали снижается (рис. 4.15). Зависимость КП = f (П2) экспериментально прослеживается менее четко, что можно заметить по разбросу опытных точек. Влияние сульфатов на процесс образования защитного слоя проявляется более сложно и главным образом в начальной стадии формирования гидроокиси железа. В условиях нейтральной среды процесс ускорения коррозии стали в водных сульфатных растворах представляется следующим образом:
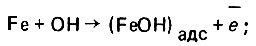 (4.137)
(4.137)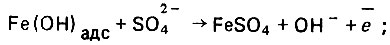 (4.138)
(4.138)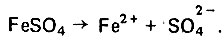 (4.139)
(4.139)
Рис. 4.15. Зависимость КП = f (П2) для образцов из Ст3 в водном растворе при различной щелочности и концентрации сульфатов (по И. С. Родиной)
Коррозионная активность воды, содержащей сульфаты, проявляется также в условиях положительного индекса карбонатного насыщения (Б. Л. Рейзин, 1976). В присутствии сульфатов пассивирующая пленка, образующаяся на поверхности металла, имеет непрочную рыхлую структуру. Кроме того, в этом случае сульфаты могут служить продуктом для развития сульфат-восстанавливающих бактерий. Конечным продуктом восстановления сульфатов является сероводород, главным образом в условиях, близких к анаэробным, т. е. при незначительном содержании растворенного кислорода. При совместном содержании хлоридов и сульфатов общее влияние их на коррозионную активность воды заметно усиливается, что, по-видимому, связано с конкурентной адсорбцией ионов обоих компонентов в защитной пленке металла. В связи с этим, помимо лабораторных экспериментальных исследований, были проведены натурные многолетные наблюдения за коррозионной стойкостью водопроводной сети из стальных труб в системе водоснабжения города питьевой опресненной водой, приготовляемой из промышленного дистиллята с добавкой артезианской минерализованной воды. Установлено, что стабильное качество водопроводной воды по содержанию продуктов коррозии (железа менее 0,2-0,3 мг/л) было достигнуто при значительных значениях параметров П1>0,45 и П2>0,35 и общем солесодержании в пределах 300-400 мг/л. При снижении значений параметров П1 и П2 примерно в 2 раза содержание железа в водопроводной воде возрастало до 0,5-0,7 мг/л и более. При этом заметно увеличивалось число аварий на водопроводной сети вследствие образования коррозионных сквозных язв и и свищей.
Кондиционирование питьевой опресненной воды является завершающим этапом коррекционной обработки опресненной воды. Основная цель этой обработки состоит в том, чтобы довести опресненную воду до питьевого качества, удовлетворяющего ГОСТ 2874-82 и дополнительным требованиям санитарно-эпидемиологических органов СССР. Очищенная и обогащенная опресненная вода подвергается обработке по схеме: фторирование, стабилизация, обеззараживание.
Фторирование опресненной воды производят путем дозировки водного раствора фтористой соли. В качестве реагента удобно использовать фтористый натрий, который хорошо растворяется в воде. Водный раствор фтористого натрия имеет нейтральную реакцию. Расчетную дозу фтора определяют с учетом содержания его в опресненной воде.
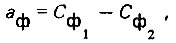 (4.140)
(4.140)где Сф1 - необходимая концентрация фтора в искусственно приготовленной питьевой воде; Сф2 - содержание фтора в опресненной воде или смеси ее с минерализованной водой.
Величину Сф2 в смеси можно вычислить по формуле (4.111), а затем уточнить анализом соответствующей пробы опресненной воды или ее смеси с минерализованной водой.
Процесс обогащения опресненной воды кальций- и гидрокарбонат-ионами находится в прямой зависимости от времени контакта агрессивной углекислоты с зернистым карбонатом кальция в режиме фильтрования. Это характерно для реакций, протекающих в кинетической области. При этом концентрация агрессивной углекислоты вдоль пути фильтрования опресненной воды через слой зернистой кальций-карбонатной загрузки вначале убывает интенсивно, а затем этот процесс постепенно замедляется. Зависимость Су.ф = f (τ) представляет собой вогнутую нисходящую кривую, асимптотически приближающуюся к оси абсцисс. В этом случае Су → 0 при τ очень большом, что практически невозможно. Поэтому проскок агрессивной углекислоты в фильтрат является неизбежным, однако желательно, чтобы ее количество было возможно малым. С увеличением солесодержания в процессе обогащения опресненная вода становится забуференной системой и часть проскоковой агрессивной углекислоты переходит в неагрессивную форму. Однако другая часть ее может сохраниться агрессивной, способной растворять защитную окисную пленку металла. Содержащийся в воде кислород усиливает коррозионное воздействие на незащищенную поверхность металла. Таким образом, стабилизационная обработка воды по существу сводится к связыванию проскоковой агрессивной углекислоты. Лучше всего это достигается путем подщелачивания фильтрата водным раствором извести по уравнениям:
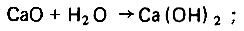 (4.141)
(4.141) (4.142)
(4.142)В этом случае вода дополнительно обогащается кальций-ионом эквивалентно расходу окиси кальция. При подщелачивании воды кальцинированной содой (вместо извести) протекает следующая реакция связывания агрессивной углекислоты:
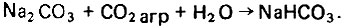 (4.143)
(4.143)В процессе стабилизационной обработки несколько повышается щелочность и рН воды.
Обеззараживание воды чаще всего осуществляют путем ее хлорирования. Пои введении активного хлора в воду образуется хлорноватистая кислота, обладающая бактерицидными свойствами;
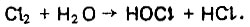 (6.144)
(6.144)В водной среде хлорноватистая кислота диссоциирует на гипохлорит-ион и ион водорода:
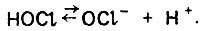 (4.145)
(4.145)Этот процесс сопровождается некоторым снижением бактерицидного эффекта. Поэтому рН следует ограничить на уровне 8,3-8,5, как это предусмотрено санитарными нормами.
Процесс обеззараживания воды можно описать показательной функцией
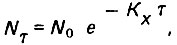 (4.146)
(4.146)где N0 - начальное число болезнетворных микроорганизмов; Nτ - число микроорганизмов в каждый момент времени; τ - продолжительность воздействия; Кх - константа скорости процесса.
Влияние обеззараживающего агента учитывается следующим образом:
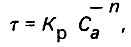 (4.147)
(4.147)где Са - концентрация обеззараживающего агента; n - коэффициент разбавления; Кр - константа резистентности микроорганизмов в отношении обеззараживающего агента.
Величина Кр зависит от вида микроорганизмов, свойств обеззараживающего агента и рН воды. Например: при рН = 7,0 бактерий coli Кр = 0,15, с увеличением рН воды Кр также возрастает.
Влияние температуры воды на скорость процесса ее обеззараживания определяют по формуле
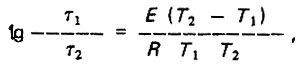 (4.148)
(4.148)где τ1 и τ2 - время, необходимое для снижения в воде бактерий на заданный процент при температуре воды соответственно T1 и T2; E - энергия активации; R - газовая постоянная, равная 1,99 кал*моль.
Для увеличения времени бактерицидного воздействия активного хлора и предотвращения образования неприятных запахов и привкусов осуществляют предварительную аммонизацию воды путем дозировки аммиака, который вступает в реакцию с хлорноватистой кислотой по уравнению
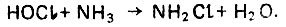 (4.149)
(4.149)Монохлорамин NH2Cl менее бактерициден, но более стоек во времени, что особенно важно в производственных условиях эксплуатации системы хозяйственно-питьевого водопотребления. Более бактерициден дихлорамин, который образуется в результате следующей реакции:
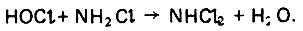 (4.150)
(4.150)При определении дозы активного хлора необходимо учитывать хлоропоглощаемость воды, которая в основном обусловлена побочными окислительно-восстановительными процессами. Расчетная доза активного хлора равна сумме двух величин - хлоропоглощаемости воды и необходимой концентрации активного хлора в ней для обеспечения обеззараживания ее в водопроводной сети за время транспортирования до потребителей.
Основная сложность хлорирования питьевой воды в производственных условиях эксплуатации состоит в том, чтобы не допустить высокую концентрацию хлора в начале сети у первых потребителей и сохранить минимальную концентрацию его у самых отдаленных потребителей (0,1 - 0,3 мг Сl2/л). В противных случаях могут возникнуть замечания местной санитарно-эпидемиологической станции и жалобы населения.
© ECOLOGYLIB.RU, 2001-2020
При использовании материалов сайта активная ссылка обязательна:
http://ecologylib.ru/ 'Зелёная планета - экология и охрана природы'
При использовании материалов сайта активная ссылка обязательна:
http://ecologylib.ru/ 'Зелёная планета - экология и охрана природы'