ПОИСК:

5 1.1. Феромоны беспозвоночных животных
Выделяют в зависимости от функций несколько групп феромонов, в том числе: 1) половые феромоны; 2) феромоны тревоги; 3) феромоны аггрегации; 4) следовые феромоны; 5) феромоны метки (marking pheromones); 6) нефункциональные феромоны [Harborne, 1982; Locke, Smith, 1980; Wegler, 1981; Leonhardt Bereza, 1982; Bell, Carde, 1984; Mohl, 1985; Скиркявичюс, 1986, 1988]
![Рис. 26. Некоторые феромоны насекомых [Kuwahara, Mori, 1983; Chuman et al., 1983; Attygale, Morgan, 1983; и др.] 1 - половой феромон мухи цеце Glossina pallidipes Austen - 13,23-диметилпентатриаконтан (dimethylpentatriacontane); 2 - половые феромоны сигаретного жука Lasioderma serricorne F. - (2,3-цис)-серрикорон (serricorone) (2a) и (2,3-цис)-серрикорол (serricorole) (26); 3 феромоны следа муравья Tetramorium caespitum L.- 2,5-диметилпиразин (2,5-dimethylpyrazine) (За) и 3-этил-2,5-диметилпиразин (36) в соотношении 70 : 30; 4 - агрегационный феромон самцов жука Cryptolestes ferrugineus (Stephens): 4а - феррулактон I или (Е, Е)-4,8-диметил-4,8-дека диен-10-олид, 46 - феррулактон и или (3Z, 118)-3-додецен-11-олид; б - агрегационный феромон самцов жука хрущака каштанового Tribolium castaneum - (4R, 8R)-(-)-4,8-диметилдеканаль (dimethyldecanal)](pic/000058.jpg)
Рис. 26. Некоторые феромоны насекомых [Kuwahara, Mori, 1983; Chuman et al., 1983; Attygale, Morgan, 1983; и др.] 1 - половой феромон мухи цеце Glossina pallidipes Austen - 13,23-диметилпентатриаконтан (dimethylpentatriacontane); 2 - половые феромоны сигаретного жука Lasioderma serricorne F. - (2,3-цис)-серрикорон (serricorone) (2a) и (2,3-цис)-серрикорол (serricorole) (26); 3 феромоны следа муравья Tetramorium caespitum L.- 2,5-диметилпиразин (2,5-dimethylpyrazine) (За) и 3-этил-2,5-диметилпиразин (36) в соотношении 70 : 30; 4 - агрегационный феромон самцов жука Cryptolestes ferrugineus (Stephens): 4а - феррулактон I или (Е, Е)-4,8-диметил-4,8-дека диен-10-олид, 46 - феррулактон и или (3Z, 118)-3-додецен-11-олид; б - агрегационный феромон самцов жука хрущака каштанового Tribolium castaneum - (4R, 8R)-(-)-4,8-диметилдеканаль (dimethyldecanal)
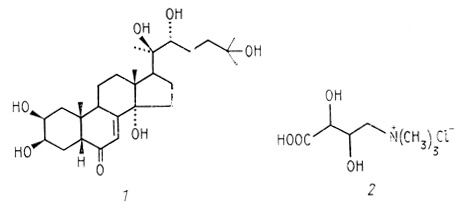
Рис. 27. Феромоны некоторых морских беспозвоночных 1 - крустэкдизон (crustecdysone) служит половым феромоном для нескольких видов крабов, 2 - антоплеурин (anthopleuriri), феромон тревоги морского анемона Anthopledra
Указанные группы феромонов установлены для наземных бес- позвоночных, прежде всего насекомых (рис. 26).
Менее изучены феромоны водных беспозвоночных, но уже сей- ас ясно, что они также разнообразны по функциям и включают в я половые феромоны (рис. 27), стимуляторы развития яичники в, ингибиторы роста, стимуляторы двигательной активности ( сопоставимые с феромонами тревоги насекомых) и некоторые Другие хемоэффекторы.
![Таблица 32. Скорость выделения феромонов некоторыми чешуекрылым (по [Лебедева и др., 1984])](pic/000060.jpg)
Таблица 32. Скорость выделения феромонов некоторыми чешуекрылым (по [Лебедева и др., 1984])
Для изучения феромонов и разработки методов их практического использования большое значение имел прогресс методов их идентификации, который привел к тому, что для характеристики структуры компонентов феромона в некоторых случаях достаточно вещества, получаемого всего от нескольких особей насекомых [Лебедева и др., 1984]. Дополнительная информация о методах изучения феромонов дана в работах [Mandava, 1985; Воронкова, 1987].
Наиболее тщательно разработаны методы работы с феромонами чешуекрылых.
Все способы выделения феромонов чешуекрылых подразделяются на три группы: 1) смыв компонентов феромонов с поверхности феромонной железы и вообще кончика брюшек при коротком контакте растворителя с биологическим материалом, 2) экстракция при длительном контакте растворителя с биологическим материалом, 3) сбор из паровой фазы над железой [Воронкова, 1987]. В зависимости от метода выделения феромонов получают разное процентное соотношение компонентов (что может быть связано с их разной летучестью, т. е. парциальным давлением паров). Минорные в экстракте компоненты могут увеличивать свои относительные количества в паровой фазе за счет большей летучести паров.
В. В. Воронкова [1987] отмечает, что необходимо исследовать и экстракты желез, и паровую фазу.
Половые феромоны. Исторически первым половым феромоном (точнее, его компонентом), структура которого была установлена, оказался бомбикол из самок бабочки тутового шелкопряда. Из 500 000 бабочек было выделено 12 мг бомбикола в виде производного. Предельная действующая концентрация природного бомбикола - 10-12 мкг/мл. Сейчас число изученных половых феромонов составляет более 1200.
Иногда при характеристике половых феромонов их подразделяют на аттрактанты (вещества, способствующие сближению самца и самки) и афродизиаки - химические вещества, выделяемые особями при приближении потенциальных половых партнеров друг к другу и способствующие подготовке индивидов другого пола к копуляции.

Таблица 33. Некоторые примеры половых феромонов насекомых и их
Феромоны самцов насекомых - очень часто именно афродизиаки, хотя некоторые действуют как аттрактанты для самок. Феромоны самцов могут выполнять различные функции, в том числе подавлять двигательную активность самок, прекращать выделение самками их феромонов, маскировать феромон самок и тем самым предотвращать подлет новых самцов.
Скорость эмиссии феромонов составляет обычно от долей до нескольких сот нанограммов в час одной самкой (табл. 32), чего, по-видимому, достаточно для формирования пахнущего облака или струи воздуха, привлекающей самцов.
Чувствительность феромонной коммуникации очень велика, например, у тараканов (весьма чувствительных к половым феромонам) предельная действующая концентрация составляет 14 мгк/мл. Однако расстояние феромонной коммуникации, как сейчас показано, меньше, чем считалось ранее; оно составляет не километры (как полагали раньше), а десятки и сотни метров.
Примеры половых феромонов даны на рис. 26 и в табл. 33. Нередко половым феромоном служит смесь нескольких веществ. Пример особенно сложного комплекса веществ - эмиссия самцами восточной фруктовой мухи Dacus dorsalis Hondel смеси (в виде Дымки), куда входят: 1) тринатрийфосфат и другие фосфаты; 2) гептакозан; 3) N-(2-метилбутил)-пропионамид; 4) ряд других неидентифицированных компонентов. Самцы дынной мухи D. cucurbitae Coquillet испускают дымку, содержащую, кроме фосфатов, пентакозаи, нонакозан и Е-5-(3,6-гептадиенил) дигидро-2-3Н-фуранон [Ohinata et al., 1982].
Именно половые феромоны обусловливают иногда довольно своеобразные особенности биологии членистоногих. Так, самцы обыкновенного паутинного клеща Tetranychus urlicae Koch (очень вредоносный полифаг, питается растениями нескольких сот видов) привлекаются к покоящимся дейтонимфам, по-видимому, именно феромонами или подобными им веществами. Затем самцы дожидаются вылупления половозрелой самки и происходит спаривание [Джекобсон, 1976].
Феромоны обнаружены, по-видимому, не менее чем у 40 видов нематод, многие из которых паразитируют на растениях (см., наример, [MacKinnon, 1987; Huettel et al., 1982]). Половые феромоны нематод участвуют в механизмах репродуктивной изоляции различных рас одного вида: так, показано, что различия в половых аттрактантах предотвращают спаривание особей банановой и цитрусовой рас нематоды Radopholus similis [Huettel et al., 1982].
Некоторые новые данные о половых феромонах членистоногих содержатся в работах [Емельянов, Мыттус, 1987; Скиркявичюс, 1988].
Феромоны тревоги. Эти феромоны найдены у перепончатокрылых (муравьев, пчел), термитов, тлей, клопов. Особенно разнообразны феромоны тревоги у общественных насекомых (см., например, [Harborne, 1982; Schlee, 1986]).
Сигналы тревоги могут вырабатываться разными железами. Например, у муравьев Acanthomyops claviger пять феромонов тревоги вырабатывают железы Дюфура, находящиеся в брюшке, а пять других феромонов тревоги - мандибулярные железы.
Одно и то же вещество может служить феромоном тревоги для разных видов. Например, гексен-2-аль является активным началом секрета, образуемого при тревоге красноклопом Dysdercus intermedius (сем. Pyrrhocoridae) и муравьем Crematogaster africana. Обычно же феромоны тревоги у разных организмов все-таки отличаются, хотя специфичность этих феромонов ниже, чем специфичность половых феромонов.
Есть примеры веществ, служащих одновременно и защитными веществами, и феромонами тревоги. Так, двойную функцию несет ряд метилциклогептанов, найденных в анальных железах муравьев Acteca, а также муравьиная кислота муравьев Formica (например, [Harborne, 1982]).
Феромоны тревоги описаны и у гидробионтов. Например, у актинии Anthopleura elegantissima их роль выполняет бетаин (3-кар- бокси-2,3-диокси-N,N,N-триметил) -1-пропанаммоний, который вызывает смыкание щупалец. Это вещество выделяется поврежденной актинией и воспринимается соседними организмами. Его действующая концентрация в воде крайне мала: 3,5-10-10 моль/л (Nowe, Sheikh, 1975; см. [Остроумов, 1986]).
Феромоны тревоги, как и другие феромоны насекомых, могут быть представлены целым букетом веществ. Так, муравьи-портные (Oecophilla longinoda) реагируют на нападение хищника эмиссией смеси четырех углеводородов, куда входят: 1-гексаналь, 1-гексанол, 2-бутил-2-октеналь (biting marker), 3-ундеканон (Bradshaw, 1979; см. [Harborne, 1982]).
Термин "феромон тревоги", по-видимому, малоудачен. В ряде случаев более удачным могло бы быть выражение "феромон возбуждения" или "феромон агрессии". Весьма условно к "феромонам тревоги" можно относить и "феромоны мобилизации" (recruitment pheromones), которые выделяются некоторыми муравьями перед атакой на колонии термитов.
Агрегационные феромоны. Эти феромоны у жесткокрылых не всегда легко отличить от половых феромонов. Агрегационные феромоны довольно подробно изучены у жуков-короедов и лубоедов. Чаще всего сигналом к скоплению служит смесь нескольких веществ, являющихся друг для друга синергистами. Вот некоторые примеры агрегационных феромонов, представленных сочетанием нескольких веществ (например, [Лебедева и др., 1984]):

Изучение агрегационных феромонов некоторых жуков весьма осложнено тем, что нет четкой границы между агрегационными феромонами и репеллентами (см., например, [Лебедева и др., 1984]).
Так, у Dendroctonus adjunctus бревикомин, испускаемый самцами, действует на самок как агрегационный (привлекающий) феромон, а на других самцов того же вида как репеллент.
Самцы D. pseudotsugae испускают комбинацию ( + )-фронталина и 3-метил-2-циклогексен-1-она (МСН), которая действует на других самцов и самок этого же вида как репеллент. Однако эти же два вещества испускаются самками данного вида в сочетании с третьим веществом, (-)-3-метил-циклогексен-1-олом; эта смесь вместе с камфеном дерева-хозяина действует на других особей D. pseudotsugae (обоего пола) противоположным образом - как агрегационный феромон. Весьма сложный состав могут иметь агрегационные феромоны Diptera, как видно на примере Drosophila virilis Sturtevant (табл. 34). Агрегационный феромон самцов этого вида содержит более шести компонентов. Имеются данные о наличии у некоторых насекомых еще более сложных смесей: у самцов жука кожееда пятнистого Dermestes maculatus - значительно больше восьми компонентов (например, [Francke, 1984]).
По-видимому, агрегацию некоторых жуков на кормовых деревьях нельзя понять, опираясь на традиционную концепцию агрегационных феромонов, поскольку реально действующим аттрактивным началом является (в экологии жуков некоторых видов) не просто феромон, а комплекс феромон + летучие вещества растения (см., например, [Лебедева и др., 1984]). Этот комплекс (агрегационный аттрактант) можно выделить из воздуха над участком дерева, заселенным питающимися короедами-первопоселенцами.

Таблица 34. Примеры агрегационных феромонов некоторых насекомых
Данное обстоятельство (как и родство между феромонами и репеллентами) представляется важным, поскольку оно еще раз подчеркивает несовершенство используемого концептуального аппарата и терминологии (в данном случае экологически неадекватным оказался ранее безупречно служивший термин "феромон"), что создает дополнительную проблему в понимании экологической сути явлений.
Близкородственные виды могут иметь общий агрегационный феромон. Это показано, например, для двух видов иксодовых клещей (паразитирующих на крупных рептилиях в Австралии): Ароnomma hydrosauri и Amblyomma limbatum [Petney, Andrews, 1982].
Многие агрегационные феромоны фитофагов имеют растительное происхождение (см. ниже раздел о составе и биосинтезе феромонов) .
Большой объем дополнительных данных об агрегационных феромонах содержится в работах [Лебедева и др., 1984; Francke, 1984].
Следовые феромоны. Эти вещества (trail pheromonos) входят в состав пахучих смесей, которыми насекомые могут метить свой корм и пути, ведущие к нему. По-видимому, сейчас идентифицированы лишь основные компоненты некоторых из этих смесей. Ниже приведены некоторые следовые феромоны:
| Муравей-листорез Atta texana | метиловый эфир 4-метилпиррол 2-карбоновой кислоты |
| Термит Zootermopsis nevadensis | капроновая кислота |
| Пчела-мелипона Trogona subterranea | 2 изомера цитраля (нераль и геранцаль) |
О высокой эффективности феромонов следа говорит следующее: муравьи Atta texana распознают свой следовой феромон (метил-4- метилпиррол-2-карбоксилат) в концентрации 0,08 пг/см, или 3,48 × 108 молекул/см. Отсюда следует, что для мечения пути вокруг всего земного шара достаточно 0,33 мг этого вещества.
Следовые феромоны муравьев могут использоваться хищными членистоногими (например, жуками Staphilinidae, клещами, тысяченожками) и позвоночными (например, змеями), которые отыскивают по их запаху муравейники. Таким образом, для этих хищников феромоны следа выступают в качестве кайромонов (веществ, приносящих пользу их реципиенту, а не донору).
Феромоны метки (marking pheromones). Эти феромоны напоминают феромоны следа, но несколько отличаются от них некоторыми особенностями. Термин "феромон метки" ("marking pheromones") употребляют, когда описывают химическое маркирование хищными насекомыми или паразитоидами обследованных ими территорий. Такие маркеры обнаружены также и у хищных клещей. Благодаря маркированию увеличивается эффективность поиска жертв и сокращается затрачиваемое на него время.
В частности, феромоны такого типа найдены у хищного клеща фитссейулюса Phytoseiulus, который является перспективным средством биологической борьбы с клещами-вредителями в теплицах.
Очень важной разновидностью феромонов этого типа являются так называемые детерренты овипозиции. Эти вещества, которыми откладывающие яйцо самки насекомых метят либо само яйцо, либо субстрат, на который оно отложено. Это позволяет избежать повторной откладки яйца в том же самом месте, а следовательно, избежать перенаселенности данного участка после вылупления личинок и трудностей в поисках ими корма. Тем самым обеспечиваются уменьшение конкуренции и более эффективное использование кормовой базы. В экосистемном масштабе это ускоряет перенос энергии по трофическим цепям, так как уменьшается голодание и смертность ювенильных особей данного пасекомого-консумента. Такие детерренты овипозиции (откладки яиц) найдены у двукрылых, чешуекрылых и жуков сем. Bruchidae (зерновки).
Полифункциональные феромоны и другие феромоны. Для нормального функционирования колонии пчел большое значение имеет полифункциональпый хеморегулятор, вырабатываемый пчелиной маткой. Это так называемое царское вещество, куда входит 9-кето-2-транс-деценовая кислота, которое выполняет следующие функции: 1) привлекает рабочих пчел к матке; 2)при облизывании тела матки рабочие пчелы получают царское вещество; в результате у них подавляется развитие яичников; 3) царское вещество подавляет у обитателей улья стремление строить "царские ячейки" для выкармливания будущей матки; 4) компоненты царского вещества служат половым феромоном, привлекая самцов к матке во время ее брачных полетов. У других общественных насекомых вырабатываемые маткой (the queen) феромоны могут нести несколько иной набор функций.
Царское вещество проявляет наиболее высокую активность только в сочетании с другими веществами, вырабатываемыми мандибулярными железами (которые выделяют царское вещество).
Для подавления рефлекса строительства царских ячеек у колонии из 200 рабочих пчел они должны получать, по некоторым оценкам, ежедневно около 100 мкг царского вещества, т. е. 0,5 мкг на пчелу в день.
Другой пример полифункционалыюго феромона - вещества мандибулярных желез земляного шмеля Bombus terrestris (транс-2,3-дигидрофарнозол и его ацетат; этиловый эфир лаурановой кислоты) . Эти вещества одновременно являются и аттрактантами (у самцов и самок), и метчиками территории.
ПолифункционалЪные и гетерофункциональные феромоны, по- видимому, имеются у многих общественных насекомых.
Феромонная коммуникация в высшей степени разнообразна. Существуют и другие функциональные типы феромонов, кроме названных выше. Например, у пустынной саранчи Schistocerca gregaria половозрелые самцы выделяют феромон, способствующий половому созреванию других особей [Буда, Скиркявичюс, 1982].
У нематод феромоны могут участвовать также в индукции образования особей покоящейся формы, так называемой дауэр-личинки, которая не питается и способна переносить неблагоприятные условия среды. Показано участие феромона в индукции образования дауэр-личинки свободноживущей почвенной нематоды Саепог- habditis elegans [Golden, Riddle, 1984]. Дауэр-индуцирующий феромон накапливается в местообитании нематод при чрезмерном увеличении скученности (переуплотнении популяции) и лимитировании пищевых ресурсов. Интересно, что вещества, образуемые бактерией Е. coli, а также вещества, содержащиеся в экстракте дрожжей, действуют противоположно этому феромону, подавляют образование дауэр-личинок и способствуют переходу дауэр-личинок в следующую стадию - Л4, после которой следует стадия взрослой половозрелой особи.
Еще один тип феромонов - это феромоны самцов, которые ингибируют репродуктивную активность других самцов того же вида. Так, из паутины самцов пауков Schizocosa ocreala (сем. Lycosidae, пауки-волки; к этому семейству принадлежат тарантулы рода Lycosa) выделен феромон, который ингибирует характерную поведенческую реакцию (ухаживание; courtship behavior), возникающую, когда самец контактирует с паутиной самок [Ayyagari, Tietjen, 1986].
Некоторые особенности состава, структуры и биосинтеза феромонов. Вопросам структуры и синтеза феромонов (прежде всего половых и агрегационных феромонов чешуекрылых и жесткокрылых) посвящена большая литература (см., например [Лебечева. 1984; Francke, 1984; Сметник, Шумаков, 1986; Ильичев, 1988]).
Половые феромоны самок чешуекрылых представлены обычно ограниченным набором непредельных спиртов, ацетатов и альдегидов с 10-18 атомами углерода.
Строгая видовая специфичность создается либо присутствием различных веществ, служащих основными компонентами, либо различными соотношениями у разных видов одних и тех же соединений, либо наличием минорных компонентов, которые нередко составляют 1-5% от основного компонента.
Из 118 половых феромонов самок бабочек, состав которых был изучен к 1982 г., лишь 34 феромона (т. е. менее одной трети) были представлены одним компонентом. Обычно в состав феромональной смеси входит не менее 2-3 компонентов, а иногда число компонентов достигает 15 или даже более.
Например, половым аттрактантом у самок Heliothis virescens F. является смесь семи веществ. Эта смесь в 5 раз эффективнее привлекала самцов, чем комбинация из двух веществ, которая в лабораторных условиях возбуждала самцов и вызывала у них прекопуляторное поведение.
Иногда смесь состоит из двух изомеров одного вещества, причем большое значение имеет их соотношение. Например, для привлечения самцов самки чешуекрылого Archippus breviplicanus выделяют (Е)- и (г)-И-тетрадеценилацетат. Показано, что дли проявления аттрактантного действия необходимо, чтобы они были смешаны в пропорции 70:30 (Sugie et al., 1977; см. [Baker, Longhurst, 1981]).
По химической структуре феромоны жуков крайне разнообразны. Среди них есть и довольно сложные молекулы, и сравнительно простые, например: гептанол-1, гептанол-2, фенол, валериановая и н-гексановая кислоты, пентадекаи, гексадекан, гептадекан, октадекаи [Лебедева и др., 1984]. Поскольку последние могут содержаться среди прочих веществ и в различных отходах промышленности, загрязняющих биосферу, то существует определенная вероятность нарушения химической коммуникации организмов.
В некоторых случаях принципиальную роль играет хиральность феромона. Так, у японского жука Popilla japonica феромоном служит (R, Z)-5-(1-деценил) дигидро-2(ЗН)-фуранон. Рацемическая смесь этого вещества неактивна; для проявления активности необходим 95%-ный энантиомерный избыток R-изомера. В некоторых случаях действует и смесь изомеров. Например, у жука хвойного древесинника Trypodendron lineatnm (сем. короеды Scoly- tidae) феромоном аггрегации является 4,6,6-линеатин. Полевые испытания показали примерно одинаковую эффективность (+)- и (±)-линеатина.
На рис. 28 даны примеры связи между стереохимией феромонов и их активностью. Буквой А обозначены такие вещества, у которых биологически активен только один энантиомер, причем его антипод не ингибирует действие феромона. К таким феромонам относятся экзобревикомин, фронталии, α-мультистриатин и др. Буквой Б обозначены такие вещества, у которых также биологически активен только один энантиомер, но зато антипод ингибирует действие феромона. Сюда относятся диспарлюр, цис-вербенол и др. Буквой В обозначены такие феромоны, все стереоизомеры которых биологически активны,- это феромон таракана-прусака, грандизол и др. Следующая группа феромонов (обозначены Г) - пример того, как разные виды одного рода вырабатывают различные энантиомеры. В данном случае это (+)-ипсдиенол (Ips paraconfusus) и (-)-ипсдиенол (I. calligraphus). Буквой Д обозначен пример такой ситуации, когда при проявлении феромональ- ной активности требуется смесь обоих энантиомеров - в данном случае смесь (+)-сулькатола и (-)-сулькатола из Gnathotrichus sulcatus.
Феромоны различных популяций одного и того же вида насекомых могут различаться. Примером служат две популяции Ips. pini: жуки, обитающие в штате Айдахо, выделяют (-)-ипсдиенол, а жуки в штате Нью-Йорк - смесь (+) и (-)-ипсдиенола в соотношении 65 : 35. Оказалось, жуки из Айдахо "не понимают" жуков из Нью-Йорка, поскольку (+) -энантиомер подавлял реакцию жуков из Айдахо на привычный им (-)-энантиомер [Лебедева идр., 1984].
Система экологических хемомедиаторов, которая регулирует агрегацию жуков-короедов, весьма сложна, как можно судить по набору веществ, привлекающих и отпугивающих пять изученных видов Dendroctonus. Роль феромонов агрегации выполняют фронталин, бревиколин, Е-вербенол, 3-метил-2-циклогексен-1-ол. Роль репеллентов выполняют вербенол и 3-метил-2-циклогексеи-1-он. Кроме того, роль репеллентов могут также осуществлять бревикомин и Е-вербенол, которые, таким образом, могут нести двойную функцию. Кроме того, еще ряд веществ может выполнять роль синергистов. Это образующиеся в насекомых миртенол, миртеналь, Е-пинокарвеол и пинокарвон. Различные сочетания этих веществ и их оптических изомеров обеспечивают специфичность в привлечении разных видов Dendroctonus. Сверх того, необходимо подчеркнуть, что все эти вещества в природных экосистемах действуют на фоне или в сочетании с такими аттрактивными веществами дерева-хозяина, как терпеновые углеводороды: α- и β-пинеп, мирцен, камфен, Δ3-карен [Лебедева и др., 1984].
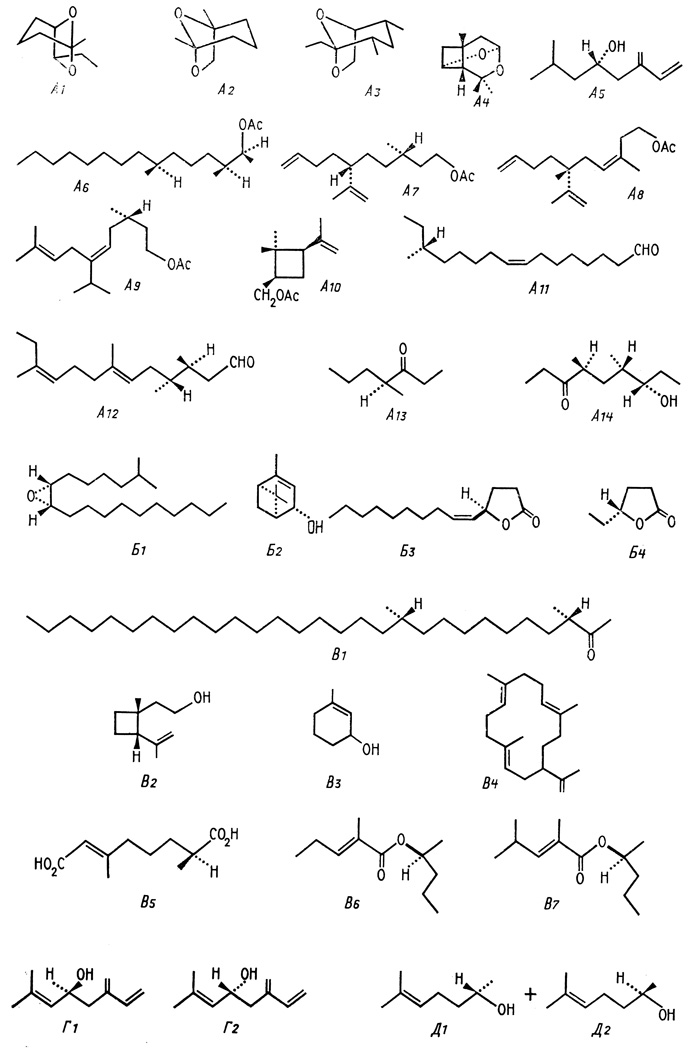
Рис. 28. Примеры связи между стереохимией и активностью феромонов (пояснения см. текст) А : 1 - экзо-бревикомин (exo-brevicomin); 2 - фронталин (frontalin); 3 - α-мультистриатин (α-multistriatin); 4 - линеатин (lineatin); 5 - ипсенол (ipsenol); 6 - феромон соснового пилильщика (pine sawfly, Diprion pini); 7,8 - феромоны щитовки красной померанцевой (California red scale, Aonidiella aurantii); 9 - феромон щитовки желтой померанцевой (yellow scale, Aonidiella citrina); 10 - феромон Planococcus citri; ll - трогодермаль (trogodermal); 12 - фараналь (faranal); 13 - феромон тревоги муравья Atta- texana; 14 - серрикорнин (serricornin); Б: 1 - диспарлюр (disparlure); 2 - цис-вербенол (cis-verbenol); з - феромон хрущика японского (Japanese beetle, Popillia japonicaR 4 - феромон Trogoderma glabrum; В: 1 - феромон таракана-прусака (Herman cockroach Blattella germanica); 2 - грандизол (grandisol); 3 - сеуденол (seudenol); 4 - неоцембрен-А (neocembrene-A); 5 - каллозобрухузовая (callosobruchusic) кислота (компонен) Феромона эректина, erectin); 6-доминикалюр-1 (dominicalure-1); 7 - доминикалюр-2 (Rhizopertha dominica); Г: l - (+)-ипсдиенол (ipsdienol); 2 - (-)-ипсдиенол; Д: 1 - (+)-энантиомер сулькатола (sulcatol); 2 - (-)-энантиомер сулькатола (Onathotrichus oulcatus)
Нередко компоненты феромональпых смесей имеют растительное происхождение. Например, у жука большого ильмового заболоштика Scolytns scolytus, который переносит возбудителя голландской болезни вязов, агрегационным феромоном служит смесь 4-метил-2-гептанола, α-кубебена, и α-мультистриаиина. Один из этих компонентов, α-кубебен, является метаболитом дерева-хозяина. В состав феромоналыюй смеси жуков Dendroctonus brevicomis входит монотерпен мирцен, образуемый деревом-хозяином.
Вообще роль растений в формировании феромонов насекомых огромна, что видно из следующих примеров (см., например, [Барьбье, 1978; Harborne, 1982; Лебедева и др., 1984; и др.]).
1. Растения и половые феромоны. Показано, что самцы бабочек данаид используют пирролизидиновые алкалоиды из растений семейства сложноцветных (а также из представителей сем. Вога- ginaceae и др.) в качестве предшественников пиррола-2 и пиррола-3 (пирролизидинона). Последние накапливаются в специальных структурах (bair pencils) и служат как аттрактанты и афродизиаки для привлечения самок и совершения брачной церемонии. Есть данные, что пирролизидинон подавляет двигательные рефлексы у летящих самок данаид, которые садятся и покорно ждут самца.
2. Растения и следовые феромоны. Из древесины, пораженной именно тем грибом, которым питается термит Zootermopsis nevadensis, была выделена капроновая кислота - феромон следа у данного термита. Возможно, и другие виды термитов используют как феромоны следа вещества, содержащиеся в их растительной пище.
3. Растения и агрегационные феромоны. Уже отмечалась роль мирцена, служащего синергистом в смеси, которая действует как агрегационный фактор у жука-лубоеда Dendroctonus brevicomis.
Содержащийся в растениях-хозяевах α-пинен служит исходным соединением для биосинтеза цнс-вербенола и транс-вербенола жуками Ips paraconfusus и D. ponderosae соответственно; последние вещества имеют феромональную активность [Byers et al., 1982]. Интересно, что превращение α-пинена в вербенол осуществлял штамм бактерии Bacillus cereus, выделенный из пищеварительного тракта жуков Ips paraconfusus. Это же превращение могут осуществлять и другие бактерии, получаемые из иных видов Ips.
Терпеноиды, содержащиеся в экскрементах хлопкового долгоносика Anthonomus grandis Boheman и служащие агрегационными феромонами, получаются в результате превращения в его организме нескольких терпенов хлопчатника, в том числе α-пинена, лимонена, β-кариофиллена и β-бисаболола.
4. Царское вещество пчелиной матки. Есть предположение, что его компоненты получаются в организме матки из ненасыщенных жирных кислот, присутствующих в. пыльце некоторых растений, в том числе в пыльце клевера.
© ECOLOGYLIB.RU, 2001-2020
При использовании материалов сайта активная ссылка обязательна:
http://ecologylib.ru/ 'Зелёная планета - экология и охрана природы'
При использовании материалов сайта активная ссылка обязательна:
http://ecologylib.ru/ 'Зелёная планета - экология и охрана природы'